問1の答 a : He, b : 18, c : 14
太陽系において, 天体望遠鏡や人工衛星を用いた観測で, 地球型惑星(水星, 金星, 地球, 火星)および火星と木星間に存在する多数の小惑星では, 水素, 酸素, 炭素以外にケイ素やマグネシウムなどの重い元素がかなり含まれている。
一方, 大きな木星型惑星(木星, 土星, 海王星)および太陽では, 多量の水素, ヘリウム, ネオン, 酸素, 炭素や窒素などの元素が主として含まれている。
宇宙物理学, 宇宙観測, 素粒子加速器実験などをベースにした宇宙の「標準理論」によれば, 137億年前に生じたビックバン以後, 素粒子(クオーク, 電子, 光子, ヒッグス粒子など)が形成され, クオークの結合による陽子と中性子に次いで, 軽元素の水素・ヘリウム・リチウムなどの原子核, 続いてそれらの原子が形成された。
その後, 水素の原始星を始め, 種々の元素から成る星や星雲の誕生・成長・爆発・死・消滅の循環を通して核反応により多くの元素(Ne, C, O, Si, Mg, Fe, Co, Ni など)が生成された。
ほとんどの元素には質量数の違う同位体元素が存在する。それらの中で, 炭素は, 天然には, 安定同位体として, 12C(98.89 %) と 13C(1.11 %), および, 不安定同位体として, 放射性の 14C(~10-10 %, 半減期:5730年)がわずかに存在する。
問2の答 3.7×10-1nm
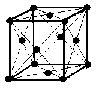
第18族, 第3周期の元素すなわちアルゴンAr の面心立方格子は下図のように図示される。ただし, 黒点は球状のAr原子の中心を表わす。
 (image2)
(image2)面心立方格子の6面の1つに注目すると, その正方形の面の対角線(長さをLとする)上に, 3つの球状(半径をrとする)のAr原子が接している。したがって, 面心立方格子の面の対角線LとAr半径rとの間には, 次の式が成立する。
L = 4r
一方, 正方形の一辺は 0.526nm に相当するので, 三平方の定理を使用すると
(0.526)2 + (0.526)2 = (4r)2
2(0.526)2 = 16r2
(1/8)(0.526)2 = r2
よって,
r = 1/{2(2)1/2}×0.526 = 1/(2×1.41)×0.526
アルゴンの原子間距離は 2r に等しいので,
アルゴンの原子間距離 2r = 0.526/1.41 = 0.37 = 3.7×10-1nm
問3の答
低温で一原子分子から成る弱い分子間結合のAr結晶は室温ではAr原子の激しい熱運動により壊れ気体となるが, KCl結晶はK+とCl-が強いイオン結合で結ばれ融点が高く室温での熱運動では壊れず安定である。
問4の答 6.5×10-2
標準状態の理想気体 1mol は 22.4Lの体積を占める。そこで標準状態で 44.8L の空気は
44.8/22.4 = 2.0 [mol]
空気 2.0 mol 中の酸素は
2.0 ×0.20 = 0.40 [mol]
酸素以外の気体(主として窒素)は
2.0 ×080 = 1.60 [mol]
酸素 O2 に紫外線を照射すると, その反応式は
3O2 → 2O3
ただし, 空気中の酸素以外の気体は反応しないとする。
反応した酸素 O2 の物質量 X [mol] とすると, 上の反応式を参照して,
未反応の酸素 O2 の物質量は : 0.40 - X [mol] …(1)
生成したオゾン O3 の物質量は : 2X/3 [mol] …(2)
以上から, 空気の照射後の物質量は
(1) + (2) + 1.60 = (0.40 - X) + 2X/3 + 1.60 = 2.0 - X/3 [mol] …(3)
2.0 mol の空気は, 反応前と比べて, 標準状態で 1.4/22.4 = 0.0625 [mol] 減少しているので,
2.0 - (2.0 - X/3) = 0.0625
よって
X/3 = 0.0625
∴ X = 0.1875 [mol]
そこで, 反応後の気体(空気)の物質量は (3) から
2.0 - X/3 = 2.0 - 0.0625 = 1.9375 [mol]
生成したオゾンの物質量は (2) から
2X/3 = (2×0.1875)/3 = 0.125 [mol]
かくして, 反応後の気体(空気)に含まれているオゾンのモル分率は
オゾンのモル分率 = 0.125/1.9375 = 0.065 = 6.5×10-2
問5の答
宇宙線強度の増加は大気中の二酸化炭素に含まれる放射性炭素の比率を増加させるが, 化石燃料の使用増加は放射性炭素の比率を減少させる。
宇宙線強度の増加は, 大気中で核反応が助長され, 二酸化炭素に含まれる放射性炭素の比率を増加させる。一方, 石油や石炭などの化石燃料中には, 化石になる以前のその当時の植物の放射性炭素が含まれおり, それは崩壊して現在では大気中よりも放射性が弱まっている。したがってその化石燃料の使用増加は, 大気中で化石燃料から生じる二酸化炭素の増加で, 大気中の放射性炭素の比率を減少させる。
問6の答 (1) と (3)
● 問6の中心の窒素原子 N は, 原子番号は 7 で, その電子配置は次のようになる :
7N : 1s22s22p3
内殻 K(n=1)の1s電子は 2個存在する。最外殻 L(n=2)の2p電子は, フントの法則により, 3つの軌道(px, py, pz)に 1個ずつ入って不対電子2p1となり, それらの電子軌道は互いに垂直に交差している。これらの電子の軌道が混成して他の原子の電子と共有結合をつくる。以上から上の電子配置を書き直すと次のようになる :
7N : 1s22s22p12p12p1 …(1)
一方, 原子間での電子分布の偏りを表わす電気陰性度において, 窒素は 3.0 である。
また, 窒素原子 N は, 最外殻の電子軌道が励起され, 次のように3つのsp2混成軌道を形成しそれぞれに1個の不対電子が入る :
7N* : 1s22p2(sp2)1(sp2)1(sp2)1 …(1)'
ただし, 7N*は励起された窒素原子を意味する。3つのsp2混成軌道は平面上で互いに120度の角度を成している。また2p軌道はその平面に垂直を成している。
さらに, 窒素原子 N は, 最外殻の電子軌道が励起され, 次のように4つのsp3混成軌道を形成しそれぞれに1個の不対電子が入る :
7N* : 1s2(sp3)2(sp3)1(sp3)1(sp3)1 …(1)''
4つのそれぞれのsp3混成軌道は正四面体の中心から互いに109.5度の角度で4つの頂点方向に向いている。
● 酸素原子 O の電子配置は,
8O : 1s22s22p4
最外殻 L(n=2)の2p電子は, 1つの2p軌道に2個の電子が入り電子対2p2となり, 他の2つの2p軌道にそれぞれ 1個の電子が入り不対電子2p1となり, それらの電子軌道は互いに垂直に交差している。以上から上の電子配置を書き直すと次のようになる :
8O : 1s22s22p22p12p1 …(2)
一方, 酸素の電気陰性度は 3.5 である。
● フッ素原子 F の電子配置は
9F : 1s22s22p5
最外殻 L(n=2)の2p電子は, 2つの2p軌道にそれぞれ2個の電子対2p2となり, 他の1つの2p軌道に1個の電子が入り不対電子2p1となり, それらの電子軌道は互いに垂直に交差している。以上から上の電子配置を書き直すと次のようになる :
9F : 1s22s22p22p22p1 …(3)
一方, フッ素の電気陰性度は 4.0 である。他の原子と比較して最も大きい値を示す。
● 水素原子 H の電子配置は, 他の原子と比較すると最も簡単で,
1H : 1s1 …(4)
K殻(n=1)に 1s電子が1個存在し不対電子を成している。一方, 水素の電気陰性度は 2.1 である。
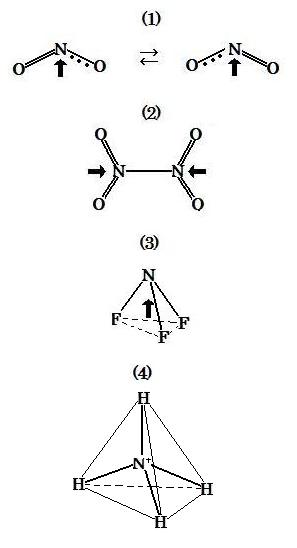
● (1)にいて, 二酸化窒素分子NO2は窒素原子に2個の酸素原子が結合している。上の(1)と(2)を参照して, 窒素原子の最外殻の電子軌道の内, 2つの2p1は, 1個の酸素原子の2つの2p1とσ結合およびπ結合で2つの共有電子対で二重結合をつくる。
窒素原子のもう1つの2p1は, 2個目の酸素原子の1つの2p1とσ結合し共有電子対をつくる。さらに窒素原子の2p2は, 2個目の酸素原子のもう1つの2p1と, 分子軌道法において, 結合軌道と反結合軌道を形成し, 2個の電子は結合軌道に, もう1個の電子は反結合軌道に入り, 三電子結合する。
以上から, 二酸化窒素の分子は, 下図(1)に示すように, 二等辺三角形で共鳴構造を形成し, 角度∠ONO は2つの酸素中の非共有電子対の互いの反発により, 90度の角度よりかなり大きくなる。一方, 電気陰性度は窒素より酸素の方が大きいので, 窒素と酸素原子間の電子は酸素側によっている。極性を示す双極性モーメントは, 図中の太い矢印のように示される。
● (2)において, 四酸化二窒素分子N2O4は2個のNO2が結合している。上の(1)'と(2)を参照して, 1個目のNO2中の励起窒素原子の最外殻電子はsp2混成軌道を形成している。
その励起窒素原子7N*中の1つ目の(sp2)1が, 1個目の酸素原子中の1つのsp1と電子対をつくりσ結合で単結合をつくり, 7N*中の2つ目の(sp2)1も2個目の酸素原子と同様にσ結合で単結合をつくる。また, 7N*中の2p2は, 2個の酸素原子中のもう1つの2p1との相互作用によりπ結合で二重結合をつくる。
2個目のNO2も, 1個目のNO2と同様な結合状態となる。そこで, 最終的に, 1個目のNO2と 2個目のNO2中にまだ結合に関与していない(sp2)1が結合して, N2O4 を形成する。
四酸化二窒素分子N2O4 は, 下図(2)に示すように, NO2において, 二等辺三角形を形成し, 角度∠ONO は120度の角度に近い値を示す。一方, 電気陰性度は窒素より酸素の方が大きいので, 窒素と酸素原子間の電子は酸素側によっているが, 面対称を持つ N2O4 において, 左右に存在するNO2の双極性モーメントは相殺され, 極性を示さない。
● (3)において, 三フッ化窒素分子 NF3 は, 上の(1)と(3)を参照して, その窒素原子中の最外殻の3つの2p1と3個のフッ素原子中の2p1と共有電子対をつくりσ結合で単結合をつくる。
下図(3)に示すように, NF3分子は三角錐型となり, ∠FNFの角度は3つのF原子中の非共有電子対の反発により90度よりかなり大きくなる。極性を示す双極性モーメントは, 図中の太い矢印のように示される。
● (4)において, アンモニウムイオン NH4+ は窒素原子に3個の水素原子が共有結合し, さらに1個の水素イオンH+が配位結合している。 上の(1)''と(4)を参照して, その励起窒素原子中の最外殻の3つの(sp3)1は, 水素原子中の1s1と共有電子対によってσ結合で単結合をつくる。また, 窒素原子中の(sp3)2は水素イオンH+と電子対を共有し配位結合をつくる。
下図(4)に示すように, NH4+ 分子は, 四面体の中心にN+が存在し, その中心から四面体の4つの頂点方向でHと電子対によって共有結合する。∠HNHの角度はほぼ109.5度である。双極性モーメントは相殺され, 極性を示さない。
 (image524)
(image524)