Japanese-English Exam Similar Question 7-1
下の問題, 問1〜問3 に答えなさい。必要ならば, 元素の相対原子量 H = 1.0, C = 12, および O = 16 を使用しなさい。
問1 理想気体の状態方程式を記述しなさい。
答
Answer the questions below, Q1〜Q3. If necessarily, use the relative atomic masses of elements, H = 1.0, C = 12, and O = 16.
Q1 State the ideal gas equation.
Answer
問2 蒸気のエタン酸 CH3COOH の密度は 400 K および 101 kPa で 2.74 g dm-3 である。
(i) 上述の条件でその酸の見かけ上の相対分子量を計算しなさい。[気体定数 R = 8.31 J K-1mol-1.]
答
Q2 The density of ethanoic acid, CH3COOH, in the vapor state, is 2.74 g dm-3 at 400 K and 101 kPa.
(i) Calculate the apparent relative molecular mass of the acid under these conditions. [Gas constant R = 8.31 J K-1mol-1.]
Answer
(ii) 上述の測定からの相対分子量が相対式量 60 と異なる理由を示しなさい。
答
(ii) Suggest why the measured relative molecular mass differs from the relative formula mass, 60.
Answer
問3 下の図は一定温度で 1 mol のアルゴンにおいて p に対してプロットされた pV の変化を示している。
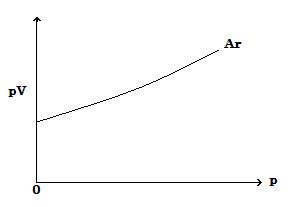 (image558)
(image558)(i) 上図をコピーして同じ温度で 1 mol の理想気体の挙動を示す線を描きなさい。
答
Q3 The figure below shows the variation in pV plotted against p for one mole of argon, at a constant temperature.
 (image558)
(image558)(i) Copy the figure and draw a line to show the behaviour of one mole of an ideal gas at the same temperature.
Answer
(ii) アルゴンがゼロ以上の圧力で理想気体として挙動しない理由を説明しなさい。
答
(ii) Explain why argon does not behave as an ideal gas at pressure above zero.
Answer