問1の答
 (image527)
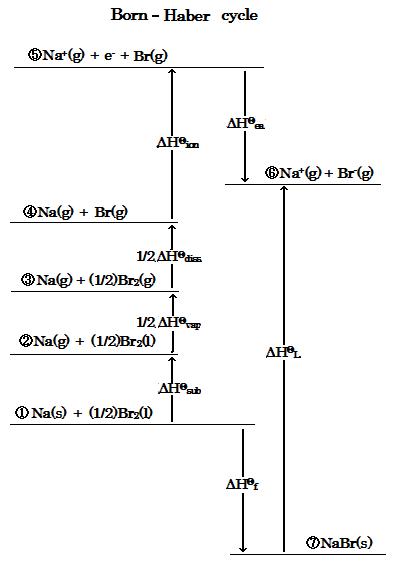
(image527)Born-Haber サイクルのステップのプロセスは次のように表される :
①Na(s) + (1/2)Br2(l) → ②Na(g) + (1/2)Br2(l) ΔHΘsub → ③Na(g) + (1/2)Br2(g) 1/2ΔHΘvap
→ ④Na(g) + Br(g) 1/2ΔHΘdiss → ⑤Na+(g) + e- + Br(g) ΔHΘion → ⑥Na+(g) + Br-(g) ΔHΘea
一方,
①Na(s) + (1/2)Br2(l) → ⑦NaBr(s) ΔHΘf → ⑥Na+(g) + Br-(g) ΔHΘL
ステップ, ①~⑦, を考慮すると, 臭化ナトリウムのそのサイクルは答の上図のようになる。
Answer of Q1
 (image527)
(image527)The process of steps in a Born-Haber cycle is represented as follows :
①Na(s) + (1/2)Br2(l) → ②Na(g) + (1/2)Br2(l) ΔHΘsub → ③Na(g) + (1/2)Br2(g) 1/2ΔHΘvap
→ ④Na(g) + Br(g) 1/2ΔHΘdiss → ⑤Na+(g) + e- + Br(g) ΔHΘion → ⑥Na+(g) + Br-(g) ΔHΘea
On the other hand,
①Na(s) + (1/2)Br2(l) → ⑦NaBr(s) ΔHΘf → ⑥Na+(g) + Br-(g) ΔHΘL
Consider the steps , ①~⑦, and so the cycle for sodium bromide is shown like the diagram of answer above.
問2の答 +30 kJ mol-1
上に与えられている Born-Haber サイクルの図を考慮すると, NaBr(l)の蒸発エンタルピー ΔHΘvap は次のように表される :
1/2ΔHΘvap = (-ΔHΘea + ΔHΘL + ΔHΘf) - (ΔHΘion + 1/2ΔHΘdiss + ΔHΘsub) …(1)
(1)式の右辺へ表中の各標準エントロピー変化の数値を代入して, ΔHΘvapを計算する。
1/2ΔHΘvap = {-(-325) + (+753) + (-361)} - {(+498) + (1/2)(+194) + (+107)} = 15
そうすると, その値は
ΔHΘvap = +30 kJ mol-1
すなわち, 私達は次のように書くことができる :
Br2(l) → Br2(g) ΔHΘvap = +30 kJ mol-1
Answer of Q2 +30 kJ mol-1
Considering the diagram of Born-Haber cycle given above, the enthalpy of vaporization for NaBr(l), ΔHΘvap , is shown as follows :
1/2ΔHΘvap = (-ΔHΘea + ΔHΘL + ΔHΘf) - (ΔHΘion + 1/2ΔHΘdiss + ΔHΘsub) …(1)
Substrate each numerical value of the standard enthalpy change in the table above for the right side of the equation, (1), to calculate ΔHΘvap.
And so the value is
ΔHΘvap = +30 kJ mol-1,
i.e. we can write as follows :
Br2(l) → Br2(g) ΔHΘvap = +30 kJ mol-1