[理由] ヒドラジンの分子間にはエタンよりも強い結合を引き起こす水素結合が存在する。
沸点は液状中の分子間の引力に依存する。液体エタン分子間の力は近似的にそのモル質量に対応するファンデルワールス力のみで弱い。 ヒドラジン分子間では, 2つの力が存在する, いわゆる, ファンデルワールス力および次のように水素結合によって形成される力である :
N-H…N
以上の結果から, ヒドラジン分子間の力が, 水素結合を含むために, より強いので, ヒドラジンはエタンよりも非常に高い沸騰温度を持つ。
Answer of Q1
[Reason] There is the hydrogen bonding between hydrazine molecules which causes stronger bond than ethane.
Boiling point depends on the force of attraction between molecules in the liquid state. The force between ethane molecules in the liquid is only the van der Waals force which corresponds approximately to the molar mass of ethane and is weak.
In the force between hydrazine molecules, there are two forces, that is, the van der Waals force and the force formed by the hydrogen bonds as follows :
N-H…N
As a result above, hydrazine has a much higher boiling temperature than ethane because the force between hydrazine molecules is more stronger, to include the hydrogen bonds.
問2
i の答 N2H4(l) + O2(g) → N2(g) + 2H2O(l)
液体ヒドラジンが酸素中で燃えると, 窒素と水を形成する。そこで, この反応に対するバランスのある式は次のように書かれる :
N2H4(l) + O2(g) → N2(g) + 2H2O(l)
ii の答 ΔHΘHYD(298K) = +52 kJ/mol
液体ヒドラジン生成の熱化学方程式は次のように表わせられる :
2H2(g) + N2(g) = N2H4(l) + Q [kJ/mol] …(1)
ここで, Q はこの反応で生じる熱の値である。
一方, ヒドラジン の燃焼に対して標準エンタルピー変化は -624 kJ mol-1 で与えられるので, その熱化学方程式は
N2H4(l) + O2(g) = N2(g) + 2H2O(l) + 624 [kJ/mol] …(2)
また, 上の表で与えられている 水 の標準生成エンタルピーを使用して,
H2(g) + (1/2)O2(g) = H2O(l) + 286 [kJ/mol] …(3)
そこで, 上の(1)を変形することによって得られた式に(2)を代入すると,
Q = {2H2(g) + N2(g)} - N2H4(l) = {2H2(g) + N2(g)} - [{N2(g) + 2H2O(l) + 624} - O2(g)] …(4)
次に(4)に(3)を代入すると,
Q = {2H2(g) + N2(g)} - [{N2(g) + 2H2O(l) + 624} - O2(g)]
= {2H2(g) + N2(g)} - [N2(g) + 2{H2(g) + (1/2)O2(g) - 286} + 624] + O2(g)
= 286×2 - 624 = -52 [kJ/mol]
かくして, ヒドラジンの計算された標準生成エンタルピーΔHΘHYD(298K)は
ΔHΘHYD(298K) = -Q = -(-52) = +52 kJ/mol
したがって,
2H2(g) + N2(g) → N2H4(l) ΔHΘHYD(298K) = +52 kJ/mol
結論として, ヒドラジンが水素と窒素の反応で形成されることは吸熱的である。
[別解]
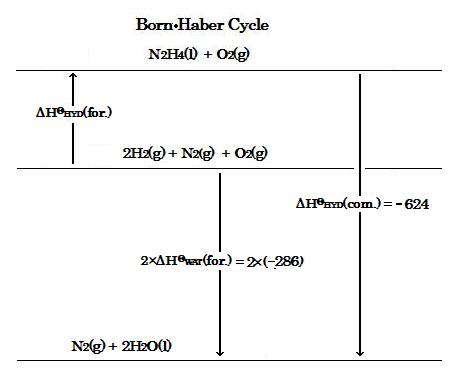
ヒドラジンの標準燃焼エンタルピーΔHΘHYD(com.), 水の標準生成エンタルピーΔHΘWAT(for.)およびヒドラジンの標準生成エンタルピーΔHΘHYD(for.)を含む下のBorn-Haber cycle図を考慮すると, 次のようにひとつの式が導かれる :
ΔHΘHYD(for.) + ΔHΘHYD(com.) = 2×ΔHΘWAT(for.)
したがって, ヒドラジンの標準生成エンタルピーΔHΘHYD(for.)は
ΔHΘHYD(for.) = 2×ΔHΘWAT(for.) - ΔHΘHYD(com.) = 2×(-286) - (-624) = +52 kJ/mol
 (image514)
(image514)Q2
Answer of i N2H4(l) + O2(g) → N2(g) + 2H2O(l)
Liquid hydrazine burns in oxygen to form nitrogen and water. So, a balanced equation for this reaction is written as follows :
N2H4(l) + O2(g) → N2(g) + 2H2O(l)
Answer of ii ΔHΘHYD(298K) = +52 kJ/mol
Thermochemical equation for forming of hydrazine is represented as follows :
2H2(g) + N2(g) = N2H4(g) + Q [kJ/mol] …(1),
where Q is the value of heat that occurs in this reaction.
On the other hand, as the standard enthalpy change for combustion of hydrazine is given -624 kJ mol-1, the thermochemical equation is
N2H4(l) + O2(g) = N2(g) + 2H2O(l) + 624 [kJ/mol] …(2).
And also, using the standard enthalpy of forming for water given in the table above
H2(g) + (1/2)O2(g) = H2O(l) + 286 [kJ/mol] …(3)
So, put (2) into the equation obtained by means of changing (1) above
Q = {2H2(g) + N2(g)} - N2H4(l) = {2H2(g) + N2(g)} - [{N2(g) + 2H2O(l) + 624} - O2(g)] …(4)
next put (3) into (4)
Q = {2H2(g) + N2(g)} - [{N2(g) + 2H2O(l) + 624} - O2(g)]
= {2H2(g) + N2(g)} - [N2(g) + 2{H2(g) + (1/2)O2(g) - 286} + 624] + O2(g)
= 286×2 - 624 = -52 [kJ/mol]
Thus, the standard enthalpy of forming, ΔHΘHYD(298K), calculated for hydrazine is
ΔHΘHYD(298K) = -Q = -(-52) = +52 kJ/mol,
accordingly,
2H2(g) + N2(g) → N2H4(l) ΔHΘHYD(298K) = +52 kJ/mol.
In conclusion, it is endothermic that hydrazine is formed with reaction of hydrogen and nitrogen.
[Another method]
Considering the diagram of Born-Haber cycle below which includes the standard enthalpy of combustion for hydrazine, ΔHΘHYD(com.), the standard enthalpy of formation for water, ΔHΘWAT(for.), and the standard enthalpy of formation for hydrazine, ΔHΘHYD(for.), an equation is shown as follows :
ΔHΘHYD(for.) + ΔHΘHYD(com.) = 2×ΔHΘWAT(for.).
Accordingly, the standard enthalpy of formation for hydrazine, ΔHΘHYD(for.) is,
ΔHΘHYD(for.) = 2×ΔHΘWAT(for.) - ΔHΘHYD(com.) = 2×(-286) - (-624) = +52 kJ/mol
 (image514)
(image514)問3
i の答 2C2H6(g) + 7O2(g) → 4CO2(g) + 6H2O(l)
ii の答 HΘETA(com.) = -1561 kJ/mol
エタンの燃焼反応の熱化学方程式は次のように表される :
C2H6(g) + (7/2)O2(g) = 2CO2(g) + 3H2O(l) + Q [kJ/mol] …(1)
ここで, Q はこの反応で発生する熱の値である。
一方, 上の表で与えられているエタン生成, 二酸化炭素生成および水生成の標準エンタルピーを使用すると, これらの熱化学方程式は
2C(s) + 3H2(g) = C2H6(g) + 85 kJ/mol …(2)
C(s) + O2(g) = CO2(g) + 394 kJ/mol …(3)
H2(g) + (1/2)O2(g) = H2O(l) + 286 kJ/mol …(4)
そこで, (1)を次のような式に変形すると
Q = {C2H6(g) + (7/2)O2(g)} - {2CO2(g) + 3H2O(l)} …(5)
そして, (5)に(2)〜(4)を導入すると
Q = [{2C(s) + 3H2(g) - 85} + (7/2)O2(g)] - [2{C(s) + O2(g) - 394} + 3{H2(g) + (1/2)O2(g) - 286}]
= -85 + 2×394 + 3×286 = 1561 kJ/mol
よって,
エタンの標準燃焼エンタルピーを HΘETH(com.) とすると,
HΘETA(com.) = -Q = -1561 kJ/mol
[別解]
エタンの燃焼反応において, 標準エンタルピーHΘETH(com.)を x [kJ/mol] とするならば, その反応式は次のように示される :
C2H6(g) + (7/2)O2(g) → 2CO2(g) + 3H2O(l) HΘETH(com.) = x [kJ/mol] …(1)
エタンの標準生成エンタルピーを HΘETH(for.), 二酸化炭素を HΘCAB(for.) および水を HΘWAT(for.) とすると, (1)において, Born-Haber サイクルを考慮すると, それらの標準エンタルピー間には次の関係が存在する :
HΘETH(com.) = 2HΘCAB(for.) + 3HΘWAT(for.) - HΘETH(for.)
そこで, 表で与えられている標準生成エンタルピーの値を使用すると,
HΘETH(com.) = x = 2×(-394) + 3×(-286) - (-85) = -1561 kJ/mol
Q3
Answer of i 2C2H6(g) + 7O2(g) → 4CO2(g) + 6H2O(l)
Answer of ii HΘETA(com.) = -1561 kJ/mol
Thermochemical equation for combustion of ethane is represented as follows :
C2H6(g) + (7/2)O2(g) = 2CO2(g) + 3H2O(l) + Q [kJ/mol] …(1)
where Q is the value of heat that occurs in this reaction.
On the other hand, using the standard enthalpies of formation of ethane, formation of carbon dioxide, and formation of water given in the table above, these thermochemical equations are
2C(s) + 3H2(g) = C2H6(g) + 85 kJ/mol …(2),
C(s) + O2(g) = CO2(g) + 394 kJ/mol …(3),
and
H2(g) + (1/2)O2(g) = H2O(l) + 286 kJ/mol …(4).
So, changing (1) into an equation as follows,
Q = {C2H6(g) + (7/2)O2(g)} - {2CO2(g) + 3H2O(l)} …(5)
and
put (2)〜(4) into (5),
Q = [{2C(s) + 3H2(g) - 85} + (7/2)O2(g)] - [2{C(s) + O2(g) - 394} + 3{H2(g) + (1/2)O2(g) - 286}]
= -85 + 2×394 + 3×286 = 1561 kJ/mol.
Accordingly, if the standard enthalpy of combustion of ethane is HΘETH(com.),
HΘETA(com.) = -Q = -1561 kJ/mol
[Another method]
In the combustion reaction of ethane, if the standard enthalpy of combustion for ethane, HΘETH(com.), is x [kJ/mol], the equation is shown as follows :
C2H6(g) + (7/2)O2(g) → 2CO2(g) + 3H2O(l) HΘETH(com.) = x [kJ/mol] …(1)
If the standard enthalpy of formation for ethane is HΘETH(for.), for carbon dioxide HΘCAB(for.) and for water HΘWAT(for.) in Born-Haber cycle, a relationship between these standard enthalpies is represented in Born-Haber cycle,
HΘETH(com.) = 2HΘCAB(for.) + 3HΘWAT(for.) - HΘETH(for.).
So, using the values of the standard enthalpies given in the table above,
HΘETH(com.) = x = 2×(-394) + 3×(-286) - (-85) = -1561 kJ/mol
問4の答
[理由] ヒドラジンは大気圧下の室温で液体であるので, エタンと比べて普通の容器に相対的に保持でき, 運搬するのに容易である。
(1) モル質量において,
ヒドラジン : N2H4 = 14.0×2 + 1.0×4 = 32.0 g mol-1 エタン : C2H6 = 12.0×2 + 1.0×6 = 30.0 g mol-1
(2) 沸点において,
ヒドラジン : 387 K エタン : 184 K
(3) 標準(298K, 1bar = 1000 hPa)でのモル体積において,
ヒドラジンは液体でその体積 vH [dm3] は, 密度およそ 1.01 g/cm3 を使用して,
vH = 32.0/1.01 = 31.7 cm3 = 3.17×10-2 [dm3] mol-1
そして, エタンは気体でその体積 vE [dm3] は, ボイル-シャルルの法則での状態式 pv = nRT を使用して,
vE = 1[mol]×83.14[hPa dm3 (K mol)-1]×298 [K]/(1000 hPa) = 24.8 [dm3] mol-1
(4) 標準燃焼エンタルピーにおいて,
ヒドラジン(液体) : -624 kJ mol-1 エタン(気体) : -1561 kJ mol-1
上述の(3)を考慮すると, ヒドラジンとエタンの同じ物質量が278 K および 1 bar で 2つの容器にそれぞれ保たれるとき, エタンの圧力はヒドラジンよりも 24.8/(3.17×10-2) ≒ 800 倍である。
それゆえ, エタンがロケット燃料として使用されるとき, かなり高圧に耐える燃料容器を作ることが必要条件である。このことは容器が重くなり, 作るのにコスト高になることを意味する。一方, ヒドラジンは大気圧下の室温で液体であるので, エタンと比べて普通の容器に相対的に保持でき, 運搬するのに容易である。
ヒドラジンとエタンが酸素中で燃焼するとき, それらの反応に対する式は
N2H4(l) + O2(g) → N2(g) + 2H2O(l) HΘHYD(com.) = -624 [kJ/mol] …(1)
C2H6(g) + (7/2)O2(g) → 2CO2(g) + 3H2O(l) HΘETH(com.) = -1561 kJ/mol …(2)
上の式を比較すると, ヒドラジンの反応(1)では燃焼生成物として無害の窒素と水を形成するが, エタン(2)では二酸化炭素を形成し, それは温室効果を助長し, いわゆる地球的規模の温暖化をもたらす。また, 使用される酸素 1 mole 当りの与えられるそのエネルギーはエタンよりもヒドラジンの方が大きい。
Answer of Q4
[Reason] As hydrazine is liquid at room temperature under atmospheric pressure, it can be kept relatively in a usual container and is easy to transport compared to ethane.
(1) In molar mass,
hydrazine : N2H4 = 14.0×2 + 1.0×4 = 32.0 g mol-1 ethane : C2H6 = 12.0×2 + 1.0×6 = 30.0 g mol-1
(2) In boiling point,
hydrazine : 387 K ethane : 184 K
(3) In molar volume at the standard (298K and 1bar = 1000 hPa),
the volume of hydrazine as liquid, vH [dm3], using the density ca. 1.01 g/cm3,
vH = 32.0/1.01 = 31.7 cm3 = 3.17×10-2 [dm3] mol-1
and
the volume of ethane as gas, vE [dm3], using the equation of state for Boyle-Charles' law, pv = nRT,
vE = 1[mol]×83.14[hPa dm3 (K mol)-1]×298 [K]/(1000 hPa) = 24.8 [dm3] mol-1
(4) In standard enthalpy of combustion,
hydrazine(l) : -624 kJ mol-1 ethane(g) : -1561 kJ mol-1
Consider (3) described above. If same molar amounts of hydrazine and ethane are kept in two containers at 278 K and 1 bar, respectively, the pressure of ethane is 24.8/(3.17×10-2) ≒ 800 times as large as hydrazine.
Therefore, when ethane is used as rocket's fuel, it is necessary condition that they make the fuel container to stand high pressure. This means that the container becomes a heavy weight and a great cost to make.
On the other hand, as hydrazine is liquid at room temperature under atmospheric pressure, it can be kept relatively in a usual container, and is easy to transport compared to ethane.
When hydorazine and ethane burn in oxygen, the equations for their reactions are
N2H4(l) + O2(g) → N2(g) + 2H2O(l) HΘHYD(com.) = -624 [kJ/mol] …(1)
C2H6(g) + (7/2)O2(g) → 2CO2(g) + 3H2O(l) HΘETH(com.) = -1561 kJ/mol …(2)
Compare these reactions above. The hydrazine reaction, (1), forms nontoxic nitrogen and water as combustion product, but ethane, (2), carbon dioxide which is causing an enhanced greenhouse effect, that is, leading to global warming. Also, the energy given out per mole of oxygen used is greater for hydrazine than for ethane.