問1
(8)の答 ③
●1 「赤熱した炭素に水蒸気を反応させると, 同じ物質量の一酸化炭素と水素からなる混合気体(水性ガス)をつくることができる。」を, 熱化学方程式で書くと, 次のようになる。ただし, 標準状態での 1.00 mol の炭素の反応熱を Q kJ/mol とする。(Q値は標準エンタルピー値を H●とすると, Q = -H● である)
C(固) + H2O(気) = CO(気) + H2(気) + Q kJ/mol …(i)
(i)式を数学的に変形すると (Qの単位省略),
Q = {C(固) + H2O(気)} - {CO(気) + H2(気)} …(i)'
●2 水蒸気の生成熱が 242 kJ/mol であるのでその熱化学方程式は, 一般に生成熱は単体の反応物から形成される生成物の 1 mol 当りの反応熱であることを考慮して, 次のようになる。
H2(気) + (1/2)O2(気) = H2O(気) + 242 kJ/mol …(ii)
●3 一酸化炭素の生成熱が 111 kJ/mol であるのでその熱化学方程式は,
C(固) + (1/2)O2(気) = CO(気) + 111 kJ/mol …(iii)
●4 (ii)式と(iii)式を変形して(i)'に代入すると (生成熱の単位省略),
(ii)式を変形,
H2O(気) = {H2(気) + (1/2)O2(気)} - 242 …(ii)'
(iii)式を変形,
CO(気) = {C(固) + (1/2)O2(気)} - 111 …(iii)'
(ii)'式と(iii)'式を(i)'に代入して変形,
Q = {C(固) + H2(気) + (1/2)O2(気) - 242} - {C(固) + (1/2)O2(気) - 111 + H2(気)}
= (-242) - (-111) = -131 kJ/mol
●5 一方, ヘスの法則を考慮して, 単体のエネルギーレベルを基準 (ゼロとする) にして, (i)式, (ii)式および(iii)式をエネルギーレベルで図示すると, 下図になる。
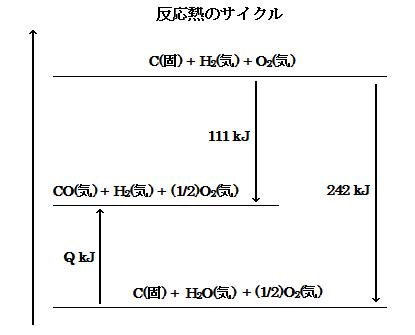 (image544)
(image544)上図から各反応熱は, 矢印(反応方向)に注意することによって, 次の関係式となる。
111 + (- Q) = 242 …ヘスの法則
よって,
Q = 111 - 242 = -131 kJ/mol
問2
(9)の答 ①
●1 熱化学方程式(問1の●1~5参照)
○ 一般の化学反応式の矢印を等号にして, 右辺に注目する物質の 1 mol 当りの反応熱 Q kJ/mol を書き加える。すなわち, 反応式の左辺と右辺がエネルギー的に等しいとする。また, 左辺と右辺のエネルギー値は, 各化合物の化学式をエネルギーの値として考え, 主として, それらの総和とする。
○ 熱化学方程式中の反応物と生成物の各化学式の後に, (固), (液), (気), または, (s), (l), (g) の物質状態を書き加える。このことは 物質の反応熱は物質状態で異なることを意味する。
○ 反応熱の値は, 発熱反応のときはプラス(+), 吸熱反応のときはマイナス(-)とする。このことは 式中の単体のエネルギーレベルを基準 (ゼロとする) にしていることを意味する。問1の●5参照。
○ 反応熱は化学変化または物理変化の種類によって名前がつけられる。(例) 生成熱, 燃焼熱, 中和熱, 溶解熱, 蒸発熱(気化熱, 凝縮熱), 融解熱(凝固熱), 昇華熱など。
●2 C2H4(気) の熱化学方程式
燃焼(酸素関与) C2H4(気) + 3O2(気) = 2CO2(気) + 2H2O(液) + QEN kJ/mol …(i)
生成(単体の反応物関与) 2C(固) + 2H2(気) = C2H4(気) + QES kJ/mol …(ii)
●3 C2H5OH(液) の熱化学方程式
燃焼 C2H5OH(液) + 3O2(気) = 2CO2(気) + 3H2O(液) + QAN kJ/mol …(iii)
生成 2C(固) + 3H2(気) + (1/2)O2(気) = C2H5OH(液) + QAS kJ/mol …(iv)
●4 問2で与えられている熱化学方程式
C2H4(気) + H2O(液) = C2H5OH(液) + Q
を変形すると,
Q = {C2H4(気) + H2O(液)} - C2H5OH(液) …(v)
上式(v)に, 問題での①に従って, ●2の(i)式と●3の(iii)式を代入すると,
Q = {2CO2(気) + 2H2O(液) + QEN - 3O2(気) + H2O(液)} - {2CO2(気) + 3H2O(液) + QAN - 3O2(気)}
= QEN - QAN
よって, 上の式 Q = QEN - QAN より, C2H4(気) と H2O(液) の反応で生じる反応熱 Q は, C2H4(気) と C2H5OH(液) の各燃焼熱, QEN と QAN を測定しその差をとることによって決めることが可能である。
上式(v)に, 問題での②に従って, ●2の(i)式と●3の(iv)式を代入すると, (ただし式中の単体のエネルギーレベルはゼロとする。問1の●5参照),
Q = {2CO2(気) + 2H2O(液) + QEN - 3O2(気) + H2O(液)} - {2C(固) + 3H2(気) + (1/2)O2(気) - QAS}
= 2CO2(気) + 3H2O(液) + QEN - QAS
ここで, 上の式中に, 2CO2(気) + 3H2O(液) が残っているので, Q は C2H4(気) の燃焼熱と C2H5OH(液) の生成熱から決められない。問題での③と④も同様に決められない。
問3
(10)の答 ③
酸化数の変化を考慮すると,
● アの反応物 Cu において, 銅に注目すると,
Cu → CuSO4
上式の左辺の単体 Cu では, 単体中の元素の酸化数はゼロであるので,
単体Cu中…Cu : 0
右辺の化合物 CuSO4 では, 化合物中のイオン価数は酸化数値と同じなので,
化合物CuSO4中…Cu : +2
以上から, Cu の酸化数は 0 から +2 に増加しているので, アの Cu は酸化されており, Cu は還元剤である。
● イの SnCl2 において, スズに注目すると,
SnCl2 → Sn
上式の左辺の化合物 SnCl2 では, 化合物中のイオン価数は酸化数値と同じなので,
化合物SnCl2中…Sn : +2
右辺の単体 Sn では, 単体中の元素の酸化数はゼロであるので,
単体Cu中…Sn : 0
以上から, Sn の酸化数は, +2 から 0 に減少しているので, イの Sn は還元されており, SnCl2は酸化剤である。
● ウとエにおいて, 同様にすると次のようになる。
Br2 → KBr では Br の酸化数は 0 から -1 に減少しているので, Br2は酸化剤である。
KMnO4 → MnSO4 では Mn の酸化数は +7 から +2 に減少しているので, KMnO4は酸化剤である。
ただし, KMnO4中のMnの酸化数は, その酸化数を X とすると, その化合物中の各元素の酸化数の総和はゼロで, カリウム K の酸化数は, 通常 +1, 酸素 O の酸化数は, 通常 -2 であるので, 次式が成立する。
(+1) + X + 4×(-2) = 0
よって,
X = +7
● 一般に, 化学反応において, 反応に関与する各化合物の酸化数を帰属するための規則が次のように示される :
(1) 化合物中のフッ素の酸化数は常に -1 である。フッ素は最も電気陰性のある元素(4.0)で常に結合上の電子を獲得する。
例
フッ化ナトリウム NaF : フッ素の酸化数は -1 でナトリウムのそれは +1 である。
フッ化カルシウム CaF2 : フッ素の酸化数の総和は 2×(-1) = -2 でカルシウムのそれは +2 である。
フッ化水素 HF : フッ素の酸化数は -1 で水素のそれは +1 である。
(2) 各電子対の割当てはより多くの電気陰性元素に帰属される。
例
臭化水素 HBr : 臭素は水素よりも多くの電気陰性, 2.8>2.1, である。そこで臭素の酸化数は -1 であり水素のそれは +1 である。
四塩化炭素 CCl4 : 塩素は炭素よりも多くの電気陰性, 3.0>2.5, である。そこで塩素の酸化数は -1 であり炭素のそれは +4 である。
(3) 化合物中の酸素の酸化数は通常 -2 である。ただし, フッ素が存在するか, あるいは過酸化物のような普通でない化合物を除く。
例
二酸化窒素 NO2 : 酸素の酸化数は -2 で窒素のそれは +4 である。
酸化ナトリウム Na2O : 酸素の酸化数は -2 でナトリウムのそれは +1 である。
[異質化合物]
二フッ化酸素 OF2 : 酸素の酸化数は +2 でフッ素のそれは -1 である。
過酸化水素 H2O2 : 酸素の酸化数は -1 で水素のそれは +1 である。
過酸化カリウム KO2 : 酸素の酸化数は同時に -1 と 0 で, カリウムのそれは +1 である。
(4) どんな化学式でもその中の全原子の酸化数の和はその化学式の上の電荷と等しくなければならない。原子あるいは分子ではその和はゼロである。イオンではその和はイオン上の電荷である。
例
二酸化硫黄 SO2 : 分子中の酸素原子の全ての酸化数は 2×(-2) = -4 である。そこで元素酸化数の和がゼロであるので硫黄の酸化数は +4 になる。
硫酸イオン SO42- : イオンの全電荷は -2 で, その元素の酸化数の和は -2 でなければならない。そのイオン中の酸素原子での酸化数の総和は 4×(-2) = -8 である。その酸素原子でのそれに硫黄の酸化数を加えると, その和は SO42- の電荷 ( -2) に等しい。
それゆえ硫黄の酸化数は (硫酸イオン電荷:-2) - (酸素原子の酸化数総和:-8) = +6 となる。
水 H2O : 酸素の酸化数は -2 である。水素原子での酸化数の総和は 2×(+1) = +2 である。それゆえ, 水分子中の元素の酸化数総和は (-2) + (+2) = 0 である。
(5) ある相における元素(単体)の酸化数はゼロである。
例
金属ニッケル Ni(s), Ni(l), あるいは Ni(g) : ニッケルの酸化数は 0 である。
酸素気体 O2(g) : 酸素の酸化数は 0 である。
問4
(11)の答 ①
① : 誤 … 純水で洗浄したのちに, 試料水溶液で洗で洗うと, メスフラスコ内にごく少量の溶質の試料が余分に入り込む。
② : 正 … 操作に使用するホールピペット内部の水溶液は, もとの水溶液の濃度を保持する。
③ : 正 … ホールピペットの標線に試料水溶液の液面の底が合うようにする。
④ : 正 … 文どおり。
⑤ : 正 … 水溶液が外にこぼれないようにする。内に不純物が混入しないようにする。均一に混ぜる。
問5
(12)の答 ③
●1 H+(水溶) または OH-(水溶) の中和反応の熱化学方程式は, 酸や塩基の化学式に関係なく, 次式で表わされる。
H+(水溶) + OH-(水溶) = H2O(液) + 56.5 kJ/mol …(i)
ここで, (水溶) は (aq) として表わすこともある。
●2 Ca(OH)2(水溶) と HCl(水溶) の中和による化学反応式は
Ca(OH)2(水溶) + 2HCl(水溶) → CaCl2(水溶) + 2H2O(液) …(ii)
(ii)式を具体的に記述すると,
Ca(OH)2(水溶) → Ca2+(水溶) + 2OH-(水溶)
2HCl(水溶) → 2H+(水溶) + Cl-(水溶)
よって, 中和反応において,
2H+(水溶) + 2OH-(水溶) → 2H2O(液)
(i)式を考慮すると,
2H+(水溶) + 2OH-(水溶) = 2H2O(液) + 113 kJ
以上から, Ca(OH)2(水溶) の塩酸 HCl(水溶) との中和による熱化学方程式は, (ii)式を考慮して,
Ca(OH)2(水溶) + 2HCl(水溶) = CaCl2(水溶) + 2H2O(液) + 113 kJ/mol …(iii)
●3 0.010 mol/L の水酸化カルシウム水溶液 100 mL 中にある水酸化カルシウムの物質量 ACa は
ACa = 0.010×(100/1000) = 0.0010 [mol]
(iii)式から, 1 mol の Ca(OH)2(水溶) の中和で, 中和熱が 113 kJ になるので, 物質量 ACa での中和熱は
ACa での中和熱 = ACa×113 = 0.0010×113 = 0.11 [kJ] (有効数字2桁)