問1
(1)の答 ⑥
● 同素体…同じ元素において, 原子配列が違うために物性・構造などの異なる分子や結晶(結晶では多形のひとつに相当する)を形成するとき, それぞれの単体の相互が同素体であるという。
例として,
○ 硫黄の同素体は, 次のようなものが存在する :
斜方硫黄S8…黄色 塊状結晶 融点113℃ 密度2.07g/cm3 環状分子S8
単斜硫黄S8…黄色 針状結晶 融点119℃ 密度1.96g/cm3 環状分子S8
ゴム状硫黄Sx…褐色 ゴム状固体 融点:不明確 鎖状分子Sx
○ 炭素の同素体は, 次のようなものが存在する :
ダイヤモンドC…正四面体形4配位(ダイヤモンド型構造) カタサ10(物質中最も硬い) 密度3.5 電気伝導性(比抵抗) 約1013Ω・cm(絶縁体) 用途:宝石, 研磨剤
黒鉛(セキボク)C…六方の層状格子構造 カタサ1~2 密度2.3 電気伝導性(比抵抗) 0.2~4.0×10-3Ω・cm (良導体, 構造上異方性が存在) 用途:電極, 鉛筆芯
フラ-レンC60…密度1.7, 60個の炭素原子が32面体(正五角形12個, 正六角形20個)のサッカーボール型に結合した分子.である。他の物質で処理すると種々の特性が出てくる。フラ-レン以外に棒状の分子も存在する。
○ リンの気体は 800℃までは P4分子として存在するが, それ以上の高温では P2分子となる。リンの同素体には, 主として, 白リン, 紫リン, 黒リンおよび無定形リンが存在するが, これらに関係して, 通常得られる黄リンは, 主成分の白リンに少し紫リンが混じったもので, 純粋なものは無色の結晶で白リンに相当する。
また, もう1つの通常得られる赤リンは, 主成分の紫リンに白リンや無定形リンが混じった固溶体である。紅リンは赤リンの微細なものに相当する。
普通, 慣習において, リンの同素体は, 次のように黄リンと赤リンに分けて考えられている :
黄リンP4…淡黄色の固体 融点44℃ 自然発火点34℃(空気中で自然に発火燃焼する, 水中に保存) 密度1.8g/cm3 有毒 水には溶けないが二硫化炭素 CS2 に溶ける。
赤リンPx…暗赤色の固体 融点590℃ 発火点260℃(摩擦で発火燃焼する, 自然発火しない) 密度2.2g/cm3 無毒 水にも二硫化炭素 CS2 にも溶けない。
○ 酸素の同素体は, 次のように酸素とオゾンに分けられる :
酸素O2…融点-218℃ 沸点-183℃ 水溶解(1ml) 0.049ml 通常の状態で無色無臭の気体
オゾンO3…融点-193℃ 沸点-111℃ 水溶解(1ml) 0.49ml 通常の状態で無色特異臭の気体 液体は淡青色
(2)の答 ④
●1 価電子(原子価電子)…原子の化学的性質は主として原子中の電子によって決まる。それらの電子において, 重要な働きをする電子を価電子または原子価電子という。原子の最外殻電子は一般に価電子として作用することが多い。
希ガス元素は安定であるため, 通常の状態では, その原子中には価電子はない。また, その他の元素の原子の価電子は, 周囲条件によって変化する。
●2 原子価…ある元素の注目する原子が, 分子内で他の原子と結合するとき, その注目する原子の結合手の数を, その元素の原子価という。
一般に, 水素の原子価を 1 (原子中に価電子 1 個存在) とし, ある元素において, 水素原子が n個と結合したとき, その元素の原子価は n 価という。直接水素と結合しない元素の原子価も間接的に定めることができる。
●3 1個の結合には, 一般に, 2個の電子が関与する。特に, 共有結合において, その 2個の電子は電子対を成している。したがって, 次式が成立する。
結合に使われている電子の総数 = (共有結合数)×(電子対の電子数2個) …(i)
●4 ①~⑥の分子式は次のようになる。
①H2 ②N2 ③Cl2 ④CH4 ⑤H2O ⑥H2S
●2と●3を考慮すると,
①H2…H は原子価 1価 で分子内に共有結合が 1個存在するので, ●3の(i)式において,
結合の電子の総数 = 1×2 = 2
②N2…N は原子価 3価で分子内に共有結合が 3個存在するので, ●3の(i)式において,
結合の電子の総数 = 3×2 = 6
③Cl2…Cl は原子価 1価 で分子内に共有結合が 1個存在するので, ●3の(i)式において,
結合の電子の総数 = 1×2 = 2
④CH4…C は原子価 4価 で分子内に共有結合が 4個存在するので, ●3の(i)式において,
結合の電子の総数 = 4×2 = 8
⑤H2O…O は原子価 2価 で分子内に共有結合が 2個存在するので, ●3の(i)式において,
結合の電子の総数 = 2×2 = 4
⑥H2S…S は原子価 2価 で分子内に共有結合が 2個存在するので, ●3の(i)式において,
結合の電子の総数 = 2×2 = 4
問2
(3)の答 ④
長周期型の元素の周期表は下図(image111)のようになる。
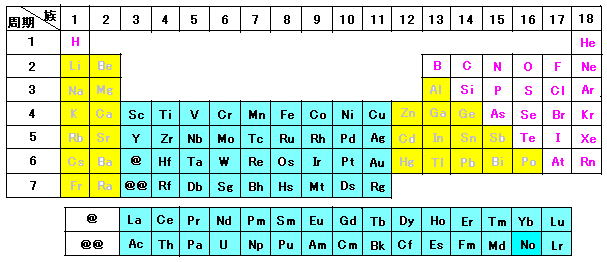
白色領域(文字:紫色), 黄色領域(文字:灰色), および水色領域(文字:黒色)にある元素はそれぞれ次のように分類される。
白色領域…典型元素(非金属) 黄色領域…典型元素(金属) 水色領域…遷移元素(金属)
各領域の性質を具体的に記述すると,
●典型元素…
○普通, 電子は原子番号の増加とともに最外殻に1個ずつ入っていく。
(例) Li…原子番号:3, 最外殻の電子数:1 Be…原子番号:4, 最外殻の電子数:2 B…原子番号:5, 最外殻の電子数:3 C…原子番号:6, 最外殻の電子数:4など
○価電子の数は, 一般に, 同じ族において, その族番号の一位の数値と一致する。ただし, 希ガス元素の価電子はゼロとする。
(例) C…族番号14, 価電子数:4 Se…族番号16, 価電子数:6 Cl…族番号17, 価電子数:7
○物理的・化学的性質が, 同周期において原子番号の増加とともにほぼ段階的に変化する。
(例)電気陰性度…Li:1.0, Be:1.5, B:2.0, C:2.5, N:3.0, O:3.5, F:4.0(全元素中で最大)
○同族の元素は化学的性質が似ている。
(例) 1族の元素は1価の陽イオンになる…H → H+ + e‐ Li → Li+ + e‐ Na → Na+ + e‐ K → K+ + e‐など
(例) 2族の元素は2価の陽イオンになる…Mg → Mg2+ + 2e‐ Ca → Ca2+ + 2e‐ Ba → Ba2+ + 2e‐など
● 遷移元素…
○普通, 電子は原子番号の増加とともに内殻に入っていく。
(例) Sc…原子番号:21, M殻:9 Ti…原子番号:22, M殻:10 V…原子番号:23, M殻:11
Cr…原子番号:24, M殻:13(12にならないのは, 3d軌道が5つありその軌道に電子が1つずつ入ると安定化することによる:) Mn…原子番号:25, M殻:13 Fe…原子番号:26, M殻:14など
○価電子は最外殻の電子に相当する。 その数は原子番号が増加しても増加せず, 普通1個か 2個である…規則性がない。
(例) Sc…原子番号:21, 価電子数:2 Ti…原子番号:22, 価電子数:2 V…原子番号:23, 価電子数:2 Cr…原子番号:24, 価電子数:1
○ 族が違っても化学的性質があまり変化しない。
(例) 融点が高い:1100~1900℃, 陽イオン:+1, +2, +3, 水溶液中では有色錯イオン形成:鉄錯イオン(褐色), コバルト錯イオン(桃色), ニッケル錯イオン(緑色), 銅錯イオン(青色) 硬度・電気伝導度・熱伝導度が大きい。磁性, 触媒性の特質を持つ。
問3
(4)の答 ③
●1 いま, 硫酸水溶液が 1 L あるとすると, その水溶液中の硫酸の質量 M [g/L] は
M = (1000 cm3)×(1.4 g/cm3)×(49/100) = 686 [g/L] …(i)
●2 硫酸 H2SO4 の相対モル質量(数値は分子量に相当)は, H, S, および O の相対モル質量(数値は原子量に相当)を使用して,
H2SO4 の相対モル質量 = 2×(1.0 g mol/L) + 1×(32 g mol/L) + 4×(16 g mol/L)
= 98 g /mol …(ii)
●3 硫酸水溶液のモル濃度 [mol/L] は, ●1(i)と●2(ii)を使用すると,
硫酸水溶液のモル濃度 = (686 g/L)/(98 g /mol) = 7.0 [mol/L] (有効数字2桁)
問4
(5)の答 ①
●1 1 mol の粒子数は, アボガドロ数 = 6.02×1023 である。
●2 ①~⑥のアンモニア, メタノール, ヘリウム, 塩化カルシウム, 黒鉛の各化学式は次のようになる :
①NH3 ②CH3OH ③He ④CaCl2 ⑤C
●1と●2を考慮して,
①…1個のアンモニア分子 NH3 中の水素原子の数は 3個存在する。また, 標準状態のアンモニア 22.4 L には, アンモニア分子 NH3 が 1 mol 存在する。そこで,
1 mol アンモニア分子中の水素原子数 = 3個×(6.02×1023) = 1.8×1024 個 (有効数字2桁)
②…1個のメタ―ノール分子 CH3OH 中の酸素原子は 1個存在する。そこで
1 mol メタノール分子中の酸素原子数 = 1個×(6.02×1023) = 6.0×1023 個(有効数字2桁)
③…ヘリウム He は, 原子番号が 2 であるので, 1個の原子中には 2個の電子が存在する。そこで,
1 mol ヘリウム分子(原子状態)中の電子数 = 2個×(6.02×1023) = 1.2×1024 個 (有効数字2桁)
④…1個の塩化ナトリウム式 CaCl2 中の塩化物イオン(塩素原子)は 2個存在する。そこで,
1 mol 塩化ナトリウム式中の塩化物イオン数 = 2個×(6.02×1023) = 1.2×1024 個 (有効数字2桁)
⑤…12 g の黒鉛(炭素 C)の物質量は, モル質量 12 g/mol (数値は原子量と同じ) を使用して,
黒鉛(炭素 C)の物質量 = (12 g)/(12 g/mol) = 1 mol
そこで,
1 mol の黒鉛中の炭素原子の数 = 6.0×1023 個 (有効数字2桁)
問5
(6)の答 ③
●1 酸素原子の原子価は 2価である。そこで, 1 mol の酸素原子には 2 mol の原子価が存在する。
●2 金属酸化物中には, 酸素が 100 - 37 = 63 %, 金属が 37 % である。この百分率を質量 g とすると,
●3 ●2の百分率%を質量 g とすると, 金属 M と酸素 O のモル比は, M の原子量 55 と O の原子量 16 から,
M : O = (37/55) : (63/16)
●4 1 mol の金属 M に存在する原子価数を X mol とすると, ●1と●3を考慮して, 次式が成立する。
M : O = (37/55) : (63/16) = X : 2
よって,
X = 2×(37/55)×(16/63) = 0.342
金属酸化物中の金属 M と酸素 O のモル比は, 整数で考えると,
M : O = 0.342 : 1 = 1 : 3
どれゆえ, 組成式は
MO3
問6
(7)の答 ②
①…発電で生じた電子を, 蓄電池の負極(-)へ取り込むことによって, 負極(-)では還元反応が起り, 同時に正極(+)では酸化反応が起こり, 蓄電池は充電される。
②…炭酸飲料は, 気体の二酸化炭素がガラス瓶などの容器の水溶液中にかなりの高圧で溶解させている。これは, 溶解する気体において, 加圧との依存を記述しているヘンリーの法則と関連する。酸化還元反応には関係ない。
③…ワインには, 主成分のひとつであるエタノールが含まれる。ワインを長い間 空気中に放置すると, ワイン中のエタノールが酸化されて酸味の酢酸に変化する。
④…有機物質の薪中の炭素と水素は, 空気中での燃焼で酸化されて二酸化炭素と水になる。
⑤…銅板葺きの屋根に含まれる銅は, 雨や湿った空気に存在する二酸化炭素によって酸化され, 青緑色の塩基性炭酸銅(II)の塩を生じる。この塩を緑青(ろくしょう)という。