問1の答 Cr2O72- + 2OH- ⇄ 2CrO42- + H2O
● 二クロム酸カリウム K2Cr2O7 水溶液は, 電離して赤橙色の二クロム酸イオン Cr2O72- を生じる。
● 水溶液中の二クロム酸イオン Cr2O72- は塩基性の OH- と反応して黄色を示すクロム酸イオン CrO42- を生じる。
● この反応は可逆反応である。
● 左辺の原子と負電荷の数と右辺の原子と負電荷の数は等しい。
問2の答 アセトン CH3COCH3 の構造式 : 下図参照
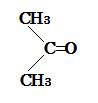 (image568)
(image568)● 硫酸酸性二クロム酸カリウム中の二クロム酸イオン Cr2O72- は, 次のように酸化作用を示し還元される。すなわち, 電子授受に注目すると, 電子 e- を 2-プロパノールから受取ってクロムイオン(III) Cr3+ を生じる。
Cr2O72- + 14H+ + 6e- → 2Cr3+ + 7H2O …(i)
● 相手の2-プロパノール CH3CH(OH)CH3 は, 次のように還元作用を示し酸化される。すなわち, 電子授受に注目すると, 電子 e- を二クロム酸イオン Cr2O72- に与えてアセトン CH3COCH3 を生じる。
CH3CH(OH)CH3 → CH3COCH3 + 2H+ + 2e- …(ii)
● (i)と(ii)を使用して, 硫酸酸性二クロム酸カリウムと 2-プロパノールの反応を 1つの式で表わす。そこで, 電子授受を消去するために, 1×(i) + 3×(ii) を考慮し,
1×(Cr2O72- + 14H+ + 6e-) + 3×(CH3CH(OH)CH3) → 1×(2Cr3+ + 7H2O) + 3×(CH3COCH3 + 2H+ + 2e-)
整理すると,
Cr2O72- + 8H+ + 3CH3CH(OH)CH3 → 2Cr3+ + 7H2O + 3CH3COCH3
K+ と SO42- を考慮すると,
K2Cr2O7 + 4H2SO4 + 3CH3CH(OH)CH3 → Cr2(SO4)3 + 7H2O + 3CH3COCH3 + K2SO4
よって,
K2Cr2O7 + 4H2SO4 + 3CH3CH(OH)CH3 → Cr2(SO4)3 + 3CH3COCH3 + K2SO4 + 7H2O
問3の答 0.086 mol・L-1
二クロム酸カリウムと 2-プロパノールの酸化還元の反応式は次のようになる。
K2Cr2O7 + 4H2SO4 + 3CH3CH(OH)CH3 → Cr2(SO4)3 + 3CH3COCH3 + K2SO4 + 7H2O
実験1において, 0.30 g の生成物アセトンの物質量は, その分子量が 3×12.0 + 6×1.0 + 1×16.0 = 58.0 から,
アセトンの物質量 = 0.30/58 = 0.00517 mol
そこで, 上の反応式において, 1mol の二クロム酸カリウム K2Cr2O7 から 3mol の アセトン CH3COCH3 が生成するので, 反応した二クロム酸カリウムの物質量は
二クロム酸カリウムの物質量 = (1/3)×0.00517 mol = 0.00172 mol
したがって, 二クロム酸カリウムの濃度を X mol・L-1 とすると次式が成立する。
X×(2.0/1000) = 0.00172
よって,
X = 0.00172×(1000/2.0) = 0.086
問4の答 98 kJ/mol
● 過酸化水素 H2O2水は, 粉末の酸化マンガン(IV) MnO2 を少量加えると, 次の反応式のように分解して気体の酸素 O2 を発生する。
2H2O2 → 2H2O + O2
ここで, 酸化マンガン(IV) MnO2 は触媒として作用しているので, 上述の反応は速くなるが, 反応後と反応前のエネルギー差は変化しない。したがって, 反応熱は, 酸化マンガン(IV) MnO2の存在には関係なく同じ値を示す。また, 生成物も同じである。
問5の答 [化学式] H2S [特徴] (1), (3)
● 硫化鉄(II) FeS が希硫酸 H2SO4 と反応すると, 腐卵臭の硫化水素 H2S の気体が発生する。その反応式は次のように書かれる。
FeS + H2SO4 → FeSO4 + H2S
ここで, 気体生成物の硫化水素 H2S の分子量は, 2×1.0 + 1×32.1 = 34.1 で, 空気の平均分子量 28.8 と比較すると大きいので, 気体の硫化水素 H2S は空気より重い。
● 発生した硫化水素は, 1部, 水に溶解し, 次のように水素イオン H+ (酸性を示す) と硫化物イオン S2- に電離し, 可逆反応で平衡状態を保持する。
H2S ⇄ 2H+ + S2-
問6の答
還元性の分子状H2Sが溶けている水溶液では, 酸化剤のKMnO4を加えると, H2SとFe2+ の2つの酸化還元反応が生じたためである。
問7の答 96%
FeSとH2SO4の反応式は, FeS + H2SO4 → FeSO4 + H2S …(i) 生成したFeSO4と硫酸酸性KMnO4との反応式は, 2KMnO4 + 8H2SO4 + 10FeSO4 → 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O …(ii)
KMnO4 1.6 g の物質量は, 式量が KMnO4 = 39.1 + 54.9 + 4×16.0 = 158 から, 1.6/158 = 0.0101 mol (有効数字3桁). そこで, KMnO4の濃度は, (0.0101mol)×(1000ml/25ml) = 0.404 mol/L
濃度 0.404 mol/L のKMnO4の滴下で, 反応したKMnO4の物質量は, (0.404 mol/L)×(5.4ml/1000ml) = 0.00218 mol (有効数字3桁)
(ii)式から, 1mol のKMnO4は 5mol の硫酸鉄(II)と反応するので, 0.00218 mol のKMnO4と反応するFeSO4(II)の物質量は, 0.00218 mol×(5mol/1mol) = 0.0109 mol
この値は, (i)式と(ii)式を参照すると, 反応するFeSの物質量に等しい。そのFeSの質量は, 式量が FeS = 55.8 + 32.1 = 87.9 であるので, FeSの質量 = (0.0109 mol)×(87.9 g/mol) = 0.96 g. よって, FeSの純度は
(0.96g/1g)×100 = 96%
● 硫酸酸性過マンガン酸カリウム中の過マンガン酸イオン MnO4- は, 次のように酸化作用を示し還元される。すなわち, 電子授受に注目すると, 電子 e- を Fe2+ から受取って Mn2+ を生じる。
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O …(i)
● 相手のFe2+ は, 次のように還元作用を示し酸化される。すなわち, 電子授受に注目すると, 電子 e- を 過マンガン酸イオン MnO4- に与えて Fe3+ を生じる。
Fe2+ → Fe3+ + e- …(ii)
● (i)と(ii)を使用して, 硫酸酸性過マンガン酸カリウムと 硫酸鉄(II) の反応を 1つの式で表わす。そこで, 電子授受を消去するために, 1×(i) + 5×(ii) を考慮し,
1×(MnO4- + 8H+ + 5e-) + 5×(Fe2+) → 1×(Mn2+ + 4H2O) + 5×(Fe3+ + e-)
整理すると,
MnO4- + 8H+ + 5Fe2+ → Mn2+ + 5Fe3+ + 4H2O
K+ と SO42- を考慮すると,
KMnO4 + 4H2SO4 + 5FeSO4 → MnSO4 + (5/2)Fe2(SO4)3 + 4H2O + (1/2)K2SO4
よって,
2KMnO4 + 8H2SO4 + 10FeSO4 → 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
● 硫化鉄(II)と硫酸は次のように反応する。
FeS + H2SO4 → FeSO4 + H2S …(i)
● 硫酸酸性過マンガン酸カリウムと硫酸鉄(II)との反応式は, 上述のように,
2KMnO4 + 8H2SO4 + 10FeSO4 → 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O …(ii)
● 過マンガン酸カリウム 1.6 g の物質量は, 式量が KMnO4 = 39.1 + 54.9 + 4×16.0 = 158 から,
過マンガン酸カリウムの物質量 = 1.6/158 = 0.0101 mol (有効数字3桁)
そこで, 過マンガン酸カリウムの濃度は
過マンガン酸カリウムの濃度 = (0.0101mol)×(1000ml/25ml) = 0.404 mol/L
● 濃度 0.404 mol/L の過マンガン酸カリウム水溶液 5.4 ml 滴下で終点に達したので, 反応した過マンガン酸カリウムの物質量は
(0.404 mol/L)×(5.4ml/1000ml) = 0.00218 mol (有効数字3桁)
● (ii)式から, 1mol の過マンガン酸カリウムは 5mol の硫酸鉄(II)と反応するので, 0.00218 mol の過マンガン酸カリウムと反応する硫酸鉄(II)の物質量は
0.00218 mol×(5mol/1mol) = 0.0109 mol
この値は, (i)式と(ii)式を参照すると, 反応する硫化鉄(II)の物質量に等しい。その硫化鉄(II)の質量は, 式量が FeS = 55.8 + 32.1 = 87.9 であるので
硫化鉄(II)の質量 = (0.0109 mol)×(87.9 g/mol) = 0.96 g
よって, 硫化鉄(II)の純度は
(0.96g/1g)×100 = 96%