[電気泳動]
I コロイド溶液, 懸濁液, エマルジョンなどの中に電極を入れ直流電圧を加えると, コロイド粒子や微細粒子が, 陽極(+)と陰極(-)のどちらかに移動する現象に相当する。それらの粒子運動は, 粒子の形状や表面電荷数, 溶媒中の電解質の種類, イオン強度, あるいはpH, 温度, 加電圧などに依存する。
II アミノ酸などの両性電解質の加電圧において, その粒子の移動が起こらないときがある。両性電解質の等電点の前後での加電圧では, 電解質の運動の方向が逆転する。
III 両性電解質の等電点は, 両性電解質やコロイド粒子の電気二重層の電位がゼロになるときの溶液の水素イオン濃度pHを意味する。
例として
(1) Al(OH)3において, そのpHで解離の状態が異なり, 等電点では Al3+ と AlO33- とが同量存在する。
(2) タンパク質において,
その溶液は, pHに依存して電気二重層の電位が正または負となる。そして, この中間に電位がゼロになるpHが存在し, このpHが等電点である。等電点でのタンパク質分子は双生イオン(電気的に中性)と呼ばれている。
タンパク質の等電点は, その分子に含まれる塩基性解離基の数と酸性解離基の数が等しくなり, 実効荷電がゼロとなったときのpHである(カゼイン:pH 4.6など)。
タンパク質中の塩基性解離基は, アミノ基-NH2, ヒスチジンの4-イミダゾリル基C3H3N2-, アルギニンのグアニジノ基NH2C(NH)NH-などである。一方, 酸性解離基は, カルボキシル基-COOH, チロシンのフェノール性水酸基-OH, シスチンのメルカプト基-SHなどである。
タンパク質の塩基性基に結合したプロトン数と酸性基から解離したプロトン数が等しくなったときのpHを特に等イオン点と呼んでいる。等イオン点は塩類の添加で変化する。
IV 一般に等電点では粒子の凝集作用や発泡などの現象がみられ, 特にタンパク質溶液は種々の特異性を示す。電気泳動の応用には, コロイド粒子の分別, 粘土の精製, ゴムや合成樹脂などの電着などがある。
以上 I~III の考察から
● 両性電解質であるアミノ酸は, 側鎖に解離する塩基性アミノ基-NH2と酸性カルボキシル基-COOHを必ず持っているので, アミノ酸水溶液のpH調整で, アミノ酸水溶液の等電点を決めることが可能となる。したがって, その等電点を基準点として, あるpHでの電気泳動で, アミノ酸を陽極(+)と陰極(-)のどちらかに移動させることが可能となる。
問2の答 (4) … (b):4.0 (c):陽極
(0)アミノ酸 RCH(NH2)COOHは, 両性物質なので, 一般に固体(結晶)では
RCH(NH3+)COO-(s)
固体のアミノ酸を純水に溶かしたとき
RCH(NH3+)COO-(s) → RCH(NH3+)COO-(aq)
もし RCH(NH3+)COO-(aq) が双生イオン(電気的に中性)の場合, 等電点が存在し,
●等電点小でのアミノ酸水溶液中では
RCH(NH3+)COO-(aq) + H+ ⇄ RCH(NH3+)COOH(aq)
生成されたイオンは陽イオンとなる。
●等電点大でのアミノ酸水溶液中では
RCH(NH3+)COO-(aq) + OH-(aq) ⇄ RCH(NH2)COO-(aq) + H2O
生成されたイオンは陰イオンとなる。
アミノ酸 F, G, H の混合物水溶液において,
(1)緩衝液の強酸添加による強い酸性領域(pH≪7)では…
pH = 2.0 において
F:陽イオン生成…電気泳動で陰極へ移動する。
G:陽イオン生成…電気泳動で陰極へ移動する。
H:陽イオン生成…電気泳動で陰極へ移動する。
[ヒント]
● アミノ酸F水溶液中の陰イオンにおいて
O-COC(NH3+)CH2CH2COO-(aq) + 2H+(aq) ⇄ HOOCC(NH3+)CH2CH2COOH(aq)
生成されたHOOCC(NH3+)CH2CH2COOH(aq)の陽イオンが電気泳動で陰極へ移動する。
● アミノ酸G水溶液中の陽イオンにおいて
O-COC(NH3+)CH2CH2CH2CH2NH3+(aq) + H+(aq) ⇄ HOCOC(NH3+)CH2CH2CH2CH2NH3+(aq)
生成されたHOCOC(NH3+)CH2CH2CH2CH2NH3+(aq)の陽イオンが電気泳動で陰極へ移動する。
● アミノ酸H水溶液中の双生イオン(中性)において
O-COC(NH3+)CH2OH(aq) + H+(aq) ⇄ HOCOC(NH3+)CH2OH(aq)
生成されたHOCOC(NH3+)CH2OH(aq)の陽イオンが電気泳動で陰極へ移動する。
(2)緩衝液の酸添加による酸性領域(pH値<7, 弱酸性)では…
pH = 4.0 において
F:等電点大で陰イオン生成…電気泳動で陽極へ移動する。
G:陽イオン生成…電気泳動で陰極へ移動する。
H:陽イオン生成…電気泳動で陰極へ移動する。
[ヒント]
● アミノ酸F水溶液中において
O-COC(NH3+)CH2CH2COO-(aq) + H+(aq) ⇄ O-OCC(NH3+)CH2CH2COOH(aq)
生成されたO-OCC(NH3+)CH2CH2COOH(aq)の双生イオン(中性)には, この(2)の領域で等電点が存在し,
その等電点より小では,
O-OCC(NH3+)CH2CH2COOH(aq) + H+(aq) ⇄ HOOCC(NH3+)CH2CH2COOH(aq)
生成されたHOOCC(NH3+)CH2CH2COOH(aq)の陽イオンは電気泳動により陰極へ移動する。
その等電点より大では,
O-OCC(NH3+)CH2CH2COOH(aq) + OH- ⇄ O-COC(NH2)CH2CH2COOH(aq) + H2O
生成されたO-COC(NH2)CH2CH2COOH(aq)の陰イオンは電気泳動により陽極へ移動する。
● アミノ酸G水溶液中において
O-COC(NH3+)CH2CH2CH2CH2NH3+(aq) + H+(aq) ⇄ HOCOC(NH3+)CH2CH2CH2CH2NH3+(aq)
生成されたHOCOC(NH3+)CH2CH2CH2CH2NH3+(aq)の陽イオンは電気泳動で陰極へ移動する。
● アミノ酸H水溶液中において,
O-COC(NH3+)CH2OH(aq) + H+(aq) ⇄ HOCOC(NH3+)CH2OH(aq)
生成されたHOCOC(NH3+)CH2OH(aq)の陽イオンは電気泳動で陰極へ移動する。
(3)緩衝液の中性領域(pH=7)では
F:陰イオン生成…電気泳動で陽極へ移動する。
G:陽イオン生成…電気泳動で陰極へ移動する。
H:等電点大で陰イオン生成…電気泳動で陽極へ移動する。
[ヒント]
● アミノ酸 F, G, H の各水溶液中において
アミノ酸F:O-COC(NH3+)CH2CH2COO-(aq) ⇄ O-COC(NH3+)CH2CH2COO-(aq)
アミノ酸Fから生成されたO-COC(NH3+)CH2CH2COO-(aq)の陰イオンは電気泳動で陽極へ移動する。
アミノ酸G:O-COC(NH3+)CH2CH2CH2CH2NH3+(aq) ⇄ O-COC(NH3+)CH2CH2CH2CH2NH3+(aq)
アミノ酸Gから生成されたO-COC(NH3+)CH2CH2CH2CH2NH3+(aq)の陽イオンは電気泳動で陰極へ移動する。
アミノ酸H:O-COC(NH3+)CH2OH(aq, 双生イオン) ⇄ O-COC(NH3+)CH2OH(aq, 双生イオン)
アミノ酸Hは, O-COC(NH3+)CH2OH(aq, 双生イオン)であるので, この(3)領域で等電点が存在し, その等電点より小では,
O-COC(NH3+)CH2OH(aq) + H+(aq) ⇄ HOCOC(NH3+)CH2OH(aq)
生成されたHOCOC(NH3+)CH2OH(aq)の陽イオンは電気泳動で陰極へ移動する。しかし今は考慮している pH = 7.0 の水溶液では, 等電点より大での反応が適合しているので, その反応は次のようになる。
O-COC(NH3+)CH2OH(aq) + OH- ⇄ O-COC(NH2)CH2OH(aq) + H2O
生成された O-COC(NH2)CH2OH(aq) の陰イオンは電気泳動で陽極へ移動する。
(4)緩衝液の塩基性領域(pH>7)では…
pH = 11.0 において
F:陰イオン生成…電気泳動で陽極へ移動する。
G:等電点大で陰イオン生成…電気泳動で陽極へ移動する。
H:等電点大で陰イオン生成…電気泳動で陽極へ移動する。
[ヒント]
● アミノ酸F水溶液中において
弱塩基性溶液で
O-OCC(NH3+)CH2CH2COOH(aq) + OH-(aq) ⇄ O-COC(NH3+)CH2CH2COO-(aq) + H2O
生成されたO-COC(NH3+)CH2CH2COO-(aq)の陰イオンは電気泳動で陽極へ移動する。
強塩基性溶液で
O-OCC(NH3+)CH2CH2COO-(aq) + OH-(aq) ⇄ O-COC(NH2)CH2CH2COO-(aq) + H2O
生成されたO-COC(NH2)CH2CH2COO-(aq)の陰イオンは電気泳動により陽極へ移動する。
● アミノ酸G水溶液中において
○弱塩基性溶液で
O-COC(NH3+)CH2CH2CH2CH2NH3+(aq) + OH-(aq) ⇄ O-COC(NH3+)CH2CH2CH2CH2NH2(aq) + H2O
生成されたO-COC(NH3+)CH2CH2CH2CH2NH2(aq)は双生イオンなので, この領域に等電点が存在する。
その等電点より小では
O-COC(NH3+)CH2CH2CH2CH2NH2(aq) + H+ ⇄ HOCOC(NH3+)CH2CH2CH2CH2NH2(aq)
生成されたHOCOC(NH3+)CH2CH2CH2CH2NH2(aq)の陽イオンは電気泳動で陰極へ移動する。
等電点より大では,
O-COC(NH3+)CH2CH2CH2CH2NH2(aq) + OH-(aq) ⇄ O-COC(NH2)CH2CH2CH2CH2NH2(aq) + H2O
生成されたO-COC(NH2)CH2CH2CH2CH2NH2(aq)の陰イオンは電気泳動で陽極へ移動する。
○強塩基性溶液で
O-COC(NH3+)CH2CH2CH2CH2NH3+(aq) + 2OH-(aq) ⇄ O-COC(NH2)CH2CH2CH2CH2NH2(aq) + 2H2O
生成されたO-COC(NH2)CH2CH2CH2CH2NH2(aq)の陰イオンは電気泳動により陽極へ移動する。
● アミノ酸H水溶液中において, 双生イオン O-COC(NH2)CH2OH(aq) は等電点より大, 言い換えると塩基性水溶液では
O-COC(NH3+)CH2OH + OH-(aq) ⇄ O-COC(NH2)CH2OH(aq) + H2O
生成されたO-COC(NH2)CH2OH(aq)の陰イオンは電気泳動で陽極へ移動する。
上述の(1)~(4)から, アミノ酸F, G, H の混合物から電気泳動でアミノ酸Fを分離するためには, 上述の(2)を考慮すると, 緩衝液はあまり強くない酸性, 言い換えると, pH値を 4.0 近傍のものを使用すると, アミノ酸Fのみが陽極側へ移動することになる。したがって, 問2の解答は(4)。
問3の答
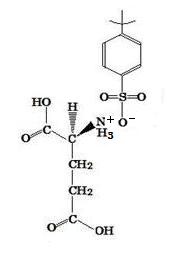 (image528-1)
(image528-1)pH2.0の希塩酸を使っているので, アミノ酸Fは, 問2(1)で解説したように, HOOCC(NH3+)CH2CH2COOH(aq)の陽イオンが生成されるので, その陽イオン中の-NH3+が, 図4のイオン交換樹脂中の-SO2O-H+の水素イオンと陽イオン交換で吸着する。
~-NH3+ + ~SO2O-H+ → ~-NH3+O-SO2~ + H+
問4の答
フラスコB : H フラスコC : G
問2の解説中の(1)~(4)を参照すると,
●操作1において, pH2.0の希塩酸を流した。 問3の解説を考慮して, アミノ酸 F, G, H の各陽イオンは, そのイオン中に-NH3+を持っているので, 全てイオン交換樹脂に吸着した。フラスコ中にはアミノ酸はなく「無」である。
●操作2において, 操作1後に緩衝液pH4.0(弱酸性)を流した。問3と問2(2)の解説を考慮して, アミノ酸 Gと Hの陽イオンがイオン交換樹脂に吸着したままでアミノ酸Fの陰イオンのみが流失した。したがって, フラスコAにはアミノ酸Fのみが含まれている。
●操作3において, 操作2後に緩衝液pH7.0(中性)を流した。問3と問2(3)の解説を考慮して, アミノ酸Gの陽イオンがイオン交換樹脂に吸着したままでアミノ酸Hの陰イオンが流失した。したがって, フラスコBにはアミノ酸Hが含まれている。
●操作4において, 操作3後に緩衝液pH11.0(弱塩基性)を流した。問3と 問2(4)の解説を考慮して, イオン交換樹脂に吸着していた陽イオンのGが陰イオンとなって流失した。したがって, フラスコCにはアミノ酸Gが含まれている。