[問題] 次の文章を読み, 以下の問1~5に答えなさい。原子量は Na=23.0, Cl=35.5 とする。
塩化ナトリウム(NaCl)は, ナトリウムイオン(Na+)と塩化物イオン(Cl-)が静電気的引力により結びついたイオン結晶である。強いイオン結合で結びついたNaCl結晶であるが, ①極性溶媒である水に入れるとその結合は切れ, Na+ と Cl- に電離して水和イオンとなり, 溶解する。
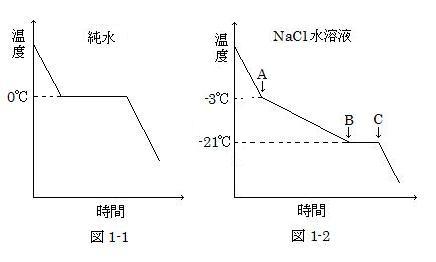
1 気圧のもとで, 純水は 0℃で凍るが, NaCl を水に溶かすと, 凝固し始める温度は 0℃以下になる。このような現象を凝固点降下と呼ぶ。凝固点は冷却曲線を調べることにより知ることができる。例えば, 純水をゆっくり冷やしていくと 0℃で氷が析出し始め, すべて氷になるまで 0℃のままである。従って, 冷却曲線は, 図1-1のように 0℃においてある時間一定となる。
今, ある濃度のNaCl水溶液をゆっくり冷やしたときの冷却曲線が, 図1-2のようになったとする。溶液が十分希薄であるとすると, 凝固点降下度から, このNaCl水溶液の濃度(質量パーセント)は( a )%と見積もられる。
 (image494)
(image494)NaCl は, 30℃では濃度 27%まで水に溶ける。30℃で色々な濃度のNaCl水溶液を準備し, 冷却曲線を調べた。その結果, 凝固点は濃度が低い水溶液を用いた実験では, 濃度に比例して降下し, 濃度が高くなると比例関係からずれてさらに降下するようになった。
しかしながら, ②凝固点は, 濃度23%の水溶液で最も低い温度に達したのち, それ以上の濃度の水溶液では変化しなくなった。
問1. 下線部①について, 水分子 H2O の形状と電荷の偏りを図示しなさい。
答
問2. 下線部①について, 水溶液中で Na+ は水分子とどのように結びついて存在しているかを, 1~2行程度で説明しなさい。
答
問3. ( a )を有効数字2桁で求めなさい。求める過程も記しなさい。ただし, 水のモル凝固点降下は 1.85 K・kg/mol とする。
答
問4. 図1-2 に示す冷却曲線において, A点(-3℃)と B点(-21℃)の間で冷却曲線が右下がりになる理由を, この間で起きている状態の変化に基づいて 1~3行程度で述べなさい。
答
問5. 下線部②について, 最も低い凝固点は何℃ですか。その理由とともに 1~3行程度で答えなさい。
答