問1の答 水分子 H2O の形状 : V字形, 電荷の偏り図は下図(image495)を参照
●ある分子が異なる2種の原子A, Bで表わされるとすると, その分子AB の A-B 結合において, 原子AとBは結合にあずかる電子を引きつける能力が異なる。この違いを表わすのに, 電気陰性度が使用される。
電気陰性度は次のようにして決められる。
●分子ABの結合A-Bにおいて, AとBとの電気陰性度の差が大きいほど, 結合A-Bのイオン性は増す。このことは, A-Bの結合エネルギーに対するイオン項の静電気的エネルギーの寄与をΔAB[kcal/mol] とすると, そのΔAB が大きくなることを意味する。
ポーリングは, A-B, A-A および B-B の各結合エネルギー DAB, DAA およびDBB を用いて, ΔABとの関係式を次のように表した :
ΔAB = DAB - (DAA + DBB)/2
ここで, 原子 A と B の電気陰性度を, それぞれχA, χB とすると,
|χA - χB| = (ΔAB/23.6)1/2
である。
上式のルート内の値はエネルギーを電子ボルト(eV)にしたものである。一方, マリケンは, 原子AとBのイオン化ポテンシャルと電子親和力との算術平均の値をMAとMBとして, 次の電気陰性度との関係式を求めた :
MA - MB = 2.78(χA - χB)
● ポーリングの電気陰性度において, 最も大きい電気陰性度の原子はフッ素 F(ハロゲン元素のひとつ)で χF = 4.0, 最も小さい電気陰性度の原子はセシウム Cs(アルカリ金属のひとつ)で χCS = 0.7 である。
● 水分子 H2O において, 水素と酸素の電気陰性度は, 水素HではχH = 2.1, 酸素OではχO = 3.5 である。したがって, 酸素の方が水素より電子を引きつける能力が大きい。そこで, 結合H-Oにおいて, 電気的かたよりが次のように生じる, すなわちその結合に極性が生じる。
Hδ+―Oδ-
ベクトルで表すと
Hδ+→Oδ-
ここで, δ+ は微小の正電荷を, δ- は微小の負電荷をあらわす。
以上から, 水分子 H2O の形状と電荷の偏りを図示すると
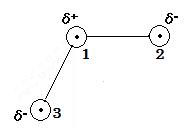 (image495)
(image495)ここで, δ+ は微小の正電荷を, δ- は微小の負電荷をあらわす。1 は酸素原子の中心, 2 と 3 は水素原子の中心を表わす。角∠213 は 104.5°である。 したがって, 水分子の形状は上図のようにV字形で極性分子である。
水分子のV字形の起因は以下のように説明される。まず, 次のように, 原子番号8の酸素原子Oの電子配置はL殻の最外殻電子において sp3混成軌道を形成する :
8O : (1s)2 (sp3)2(sp3)2(sp3)1(sp3)1
上の酸素電子配置において, 各sp3混成軌道は, 互いにほぼ 109.5°の角度で存在している。その中で, sp3において, 不対電子が2つ存在する。その酸素原子中の不対電子に対して, (1s)1 不対電子1個をもつ水素原子2個が結合して水分子を形成する。その場合, ∠HOH は 109.5°になるが, 実際は 104.5°である。これは, 主として酸素原子中に存在する2個の非共有電子対の影響によるものと考えられる。
問2の答
Na+ の周囲を, いくつかの極性の水分子がその酸素原子の微小負電荷部分を向けて静電的引力で水和し大きな水和イオンの粒子を形成している。
問3の答 4.5
[求める過程] 希薄水溶液のNaClの質量モル濃度を m [mol/水kg], 降下温度差をΔt [K] とすると,
Δt = 1.85m
図1-1 および 1-2 を参照して,
Δt = 0 - (-3) = 3 [K]
よって,
m = 3/1.85 ≒ 1.62 [mol/水kg]
希薄水溶液では, 溶解している NaCl は完全電離していることを考慮して, その NaCl の質量を W[g]とすると,
W = 58.5×(1.62/2) ≒ 47.4 [g]
よって,
質量パーセント = [47.4/(1000 + 47.5)]×100 ≒ 4.5 %
● 希薄溶液の溶質NaClの質量モル濃度を m [mol/水kg], 降下温度差をΔt [K] とすると, 次式が成立する :
Δt = 1.85m
図1-1の純水の相転移の凝固点 0℃が, 図1-2 の希薄NaCl水溶液では, -3℃に降下しているので
Δt = 0 - (-3) = 3 [K]
Δt = 3 を Δt = 1.85m に代入すると
m ≒ 1.62 [mol/水kg]
希薄水溶液では, 溶解している NaCl は完全電離していることを考慮して, その NaCl の質量を W[g]とすると, 式量 23.0 + 35.5 = 58.5 を使用して
W = 58.5×(1.62/2) ≒ 47.4 [g]
NaCl 47.4 [g] は水 1000 [g] に溶解しているので, 質量パーセントは
質量パーセント = [47.4/(1000 + 47.5)]×100 ≒ 4.53 %
よって
a = 4.5
● -3℃より高い温度で溶解している NaCl において, Na+ と Cl- に極性分子の水が水和して, かなり大きな水和イオン粒子を形成し, その大きな水和イオンが運動しているが, 希薄溶液であるため, 時間に対する冷却温度差は, Na+ と Cl- と同じ質量モル濃度に比例して降下する。それ故に, 図1-1 と図1-2 との左側において, 時間に対する冷却曲線の勾配はほぼ同じようになっている。
問4の答
ある濃度のNaCl水溶液では, -3℃〜-21℃の温度領域で溶媒の水が純水結晶に近い状態で氷になり始める。と同時に残ったNaCl水溶液の濃度は大きくなる。したがって時間に対する温度差降下の冷却曲線の直線勾配はゼロにならいで負値を持ち右下がりになる。
問5の答
最も低い凝固点 : -21℃
NaCl水溶液では-3℃(A点)から温度を下げて行くと, 溶媒の水が氷になり始め, 溶液濃度が徐々に濃くなり 23%で飽和に達して変化しなくなる。 このときが-21℃(B点)で, それ以後冷却してもNaClが析出し飽和を保ち水が全て固化(C点)するまで一定で変化しない。C点以後の冷却は氷とほぼ同じになる。
NaClの飽和水溶液が凝固するときは, 溶媒の水が純水結晶に近い状態で固体になり始めると同時に, Na+ と Cl- に水和した水分子も脱離される。Na+ と Cl- は固体の微結晶となる。完全に全体が固体になると, 図1-2の右側の冷却曲線と図1-1の右側の冷却曲線の勾配を参照して, ほぼ氷と同じように, 時間に対して一定の勾配で冷却される。