[問題] 次の文章を読み, 以下の問1~5に答えなさい。答の数値は有効数字3桁とする。
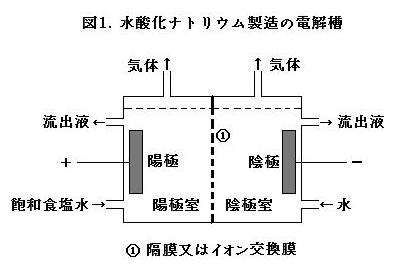
水酸化ナトリウム(NaOH)は, 工業的には食塩水の電気分解によって製造される。現在は主に, 隔膜法やイオン交換膜法が用いられている。これらの方法では, 図1に示すように, 電解槽内部が隔膜もしくはイオン交換膜により, 陽極室と陰極室に分けられる。
陽極室では, 次の反応がおこり,
[ i ][ A ] → [ ii ][ B ] + 2e- (1)
陰極室では, 次の反応がおこる。
[ iii ][ C ] + 2e- → [ iv ][ D ] + [ v ]OH- (2)
隔膜法では, 陰極室からの流出液に①Na+, Cl- , OH- が含まれるため, 純度の高い NaOH を得るために, 蒸発濃縮が必要である。
一方, イオン交換膜法では, イオン交換膜法が[ E ]のみを選択的に透過させるため, 純度の高い NaOH を得ることができる。 近年, イオン交換膜法の消費電力量削減のために, 陰極で酸素を直接還元する方法が開発されている。
O2 + [ vi ][ F ] + [ vii ]e- → [ viii ]OH- (3)
 (image443)
(image443)問1. 本文中の[ i ]~[ viii ]に適切な数値を, [ A ]~[ F ]に適切な化学式(イオン式も含む)を入れなさい。
答
問2. 下線部①に関して, 陰極室の流出液 1000g を取り出して濃度を測定したところ, NaCl および NaOH の質量パーセント濃度は, それぞれ 17.6%, 12.0%であった。NaOH を濃縮するために, 取り出した流出液を加熱して水を蒸発させ, 25℃で NaOH の飽和水溶液となるようにした。この時, 水を何g蒸発させたかを答えなさい。
なお, 25℃における NaCl および NaOH の水への溶解度は, 水 100g あたりそれぞれ 35.9g, 114g である。NaCl および NaOH の溶解度は混合溶液でも変化しないものとし, また析出物はすべて NaCl の無水物とする。
答
問3. 問2において, 濃縮後の NaOH の濃度を質量パーセント濃度で求めなさい。
答
問4. イオン交換法により食塩水の電気分解を行っていたところ, イオン交換膜に亀裂が生じ, 新たに漂白作用を示す塩を生成した。この塩の物質名と, 生成する際の反応式を記しなさい。
答
問5. イオン交換膜法における陰極反応として式(3)を用いた場合について, 陽極と陰極の反応を組み合わせた全体の熱化学方程式を記しなさい。必要あれば, 次の熱化学方程式を利用しなさい。反応熱は, いずれも 25℃, 1気圧(1.013×105 Pa)における値とする。
H2 + (1/2)O2 = H2O(液) + 286kJ
NaCl + H2O(液) = NaOH + (1/2)H2 + (1/2)Cl2 - 223kJ
答