[問題] 次の文章を読み, 以下の問1~5に答えなさい。問3~問5は答に至る過程も示しなさい。
アンモニアの電離平衡,
NH3 + H2O ⇄ NH4+ + OH-
の正反応および逆反応の反応速度について考える。
正反応の速度は,
v1 = k1[NH3]
逆反応速度は,
v2 = k2[NH4+][OH-]
と表される。ただし, k1 および k2 は反応速度定数である。
反応速度定数を決定するために次のような実験を行った。温度 20℃の希薄なアンモニア水溶液を用意した。その水溶液の温度を瞬間的に 25℃まで上昇させた。
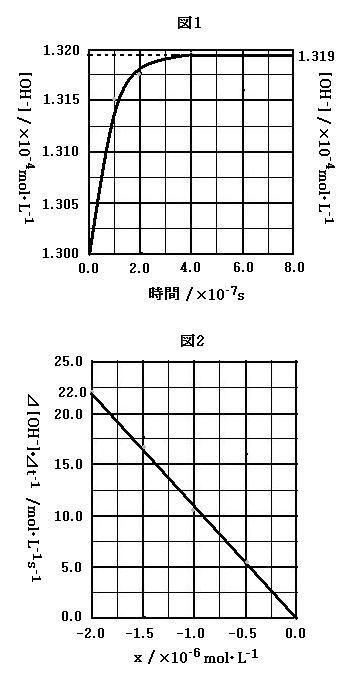
電離定数の温度依存性のため, 平衡移動が起こった。このときの[OH-]の時間変化を, 水溶液の電気伝導度を測定することにより調べた。その結果を図1に示した。図1において, [OH-]の実線は[OH-]の時間変化, 破線は時間が十分経過した後の[OH-]の値を示す。
図1の実線のグラフの傾きを解析し, 時間変化率 Δ[OH-]/Δt を, [OH-]の平衡濃度からのずれ,
x = [OH-] - [OH-]eq
の関数としてグラフにしたものを図2に示した。ただし, 記号[…]eqは 25℃の電離平衡における分子やイオンの濃度を表す。
理論的には[OH-]の時間変化率は x の 2次式,
Δ[OH-]/Δt = Ax2 + Bx (1)
で表される。図2のデータでは, 式(1)中の x2 の項が小さく無視できるため, グラフは直線になったと考えられる。
25℃におけるアンモニアの電離定数は,
Kb = 1.7×10-5 mol/L
電離平衡においては, 正反応と逆反応の速度が等しく,
k1[NH3]eq = k2[NH4+]eq[OH-]eq
であるため, 次の関係式が成立する。
Kb = k1/k2
また, アンモニア水への溶解度の温度依存性は無視できるとする。
 (image441)
(image441)問1. Δ[OH-]/Δt を k1, k2, [NH3], [NH4+], および [OH-] を用いて表しなさい。
答
問2. x の定義から OH- の濃度は [OH-] = [OH-]eq + x と表すことができる。[NH4+] を [NH4+]eq および x を用いて表しなさい。また, [NH3] を [NH3]eq および x を用いて表しなさい。
答
問3. 式(1)中のBを, k1, k2, [NH4+]eq, および [OH-]eq を用いて表しなさい。
答
問4. k2 を, B, Kb, および [OH-]eq を用いて表しなさい。
答
問5. 図1および図2のデータにもとづいて k2 の値を求め, 有効数字2桁で答えなさい。
答