問1の答 配位結合
● 答の配位結合は化学結合のひとつである。
配位結合では, 化合物中の原子に電子対が存在する場合に, その原子の電子対を共有して結合する。即ち, この結合では, 電子対が一方の原子のみから提供されて結合されることになる。
問題の [Cu(NH3)4]2+ と [Pd(NH3)4]2+ の錯イオンにおいて, 配位子 NH3 のN原子中の非共有電子対が Cu2+ または Pd2+ へ提供されて, それを共有してCu2+ または Pd2+ と 4つの NH3 が結合している。
● 化学結合
分子内で原子を互いに結合させている化学結合には, 結合の様式によって, 現在では, (1) 共有結合 (2) イオン結合 (3) 配位結合 (4) 金属結合 の4つに分類されている。実際の結合には, 共鳴により2つ以上の様式が混合される場合がある。例えば, 塩化水素の結合には, 共有結合が73%及びイオン結合が27%で共鳴して混合したものである。
(1) 共有結合…2つの原子が, スピン逆向きの2個の電子の対を共有することによって形成される結合である。同原子どうしの結合や電気陰性度に近い原子の結合は一般に共有結合される。例えば, H2のH-H間, CH4のC-H間 などがある。
2個の電子即ち電子対を共有することによって原子間に結合が形成される考え方はすでに八グウ説でいわれていたが, スピン逆向きの2つの電子が安定に結合することは量子力学で初めて明確になった。
共有結合の量子理論は, 原子軌道関数法と分子軌道関数法の2つがある。前者の原子軌道関数法では, 電子の交換で生じる交換エネルギーが結合力の主原因になる。後者の分子軌道関数法では, 2つの原子に広がる安定な結合性軌道に1組の電子対が入ることによって共有結合が形成される。
量子論の発展で結合手の本質(電子の関与:根本的には光子)が理論的に明確になり, それを基にして, 結合間隔, 結合エネルギー, 結合の極性, 結合にもとづく振動スペクトル, 結合角などが実験的に確かめられることが可能になった。
(2) イオン結合…正と負の両イオンが静電気引力によって形成される結合である。陽イオンになり易い金属や原子団と陰イオンになり易い非金属及び原子団はイオン結合して化合物をつくる。例えば, NaCl のNa+とCl-間や Na2SO4のNa+とSO42-間, NH4NO3のNH4+とNO3-間 などがある。
(3) 配位結合…この結合では, 電子対が一方の原子のみから提供されて結合される。一般に, 共有結合とイオン結合とが重なっている。半極性結合とも呼ばれる。
例として, トリメチルアミンオキシド (CH3)3NOのN-O間がある。この場合, 1 個の窒素原子は通常 3 個の原子価電子しか持っていない。したがって, 3 個のメチル基と 1 個の酸素原子とは結合しない。
結合するためには, 窒素原子内の非共有電子対からの 1 個の電子が酸素原子に移動すると, N+はCと等電子的で 4 価となる。同時に, O-は F と等電的に 1 価となる。結果として, 各元素の原子価が満足され, トリメチルアミンオキシド (CH3)3NOは次のように表される:(CH3)3N+―O−ここで, N+―O−の結合が半極性の配位結合に相当する。A, B間の配位結合は, 通常, A+―B-, A→B, A←Bなどの記号で表す。
(4) 金属結合…金属内の原子間結合で, 複数個のプラスイオンの原子核が非極在性の自由電子で結合する。Fe, Cu などがある。
● 化学結合の分類には, 上述以外に, 次のようなものがある。
○結合の多重度によって, 単結合, 二重結合, 三重結合に分ける。
○原子価電子の軌道によって, σ結合とπ結合に分ける。
● 原子価論
○原子価は, ある元素の原子が他の原子と結合しうる手の数をいう。一般に, 水素の原子価を 1 として, 水素原子 n 個と結合しうる元素の原子価を n 価と定める。直接水素と結合しない元素の原子価は間接的に定めることができる。これらの原子価の値は, 原子量を化学当量で割った値に等しくなる。量子論によれば, 原子の不対電子の数, 即ち原子価電子の数に等しくなる。
○初期において, 電気化学的二元論では, 電気的に陽性な原子と陰性な原子とが結合して分子をつくるとした。この場合, メタン分子の陽性な水素原子が陰性な塩素原子と置換される事実は説明に問題が残る。
○一元論では, 分子中には一定の骨組みが存在し, 各原子に固有な原子価が与えられる。さらに, 副原子価の概念の導入で配位説が提唱されて, 金属錯塩の形成の説明に使われた。
○ボーアの原子模型論から原子内の電子配置が明確化され, 原子内の電子構造に注目した原子価の電子論が発展した。例として, 希ガス型の電子配置が安定であることから, NaClなどにおいて, 電子授受によるイオン結合が説明なれた。また, 電子の八グウ説も提唱された。さらに, 波動方程式の応用による原子価の量子論が展開されている。
問2の答
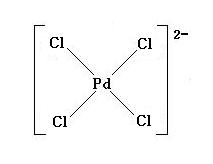 (image322)
(image322)化学反応式は
PdCl2 + 2NaCl → [PdCl4]2- + 2Na+
上の反応式から, 生成された錯イオン B :[PdCl4]2- の構造式は, 図示すると, 上の答のようになる。陰イオンの正方形構造をとる。[PdCl4]2- 中の配位子 Cl- に存在する非共有電子対によって, Pd2+ と 4個の Cl- が配位結合する。
問3の答
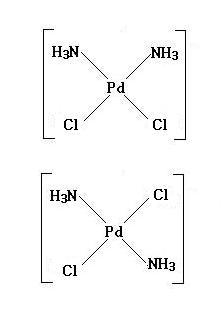
反応式は次のようになる。
PdCl2 + 4NH3 + 2HCl → [Pd(NH3)2Cl2] + 2NH4+ + 2Cl-
上の反応式より, 沈殿する化合物 C の化学式は [Pd(NH3)2Cl2] となる。[Pd(NH3)2Cl2] の異性体は, 図示すると, 次のようになる。
 (image324)
(image324)問4の答
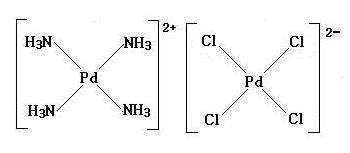 (image325)
(image325)反応式は次のようになる。
A + B → D ただし, Dは(C)2となる。 よって
[Pd(NH3)4]2+ + [PdCl4]2- → [Pd(NH3)2Cl2]2
上式より, D:[Pd(NH3)2Cl2]2 は, [Pd(NH3)4]2+ と [PdCl4]2- のイオン結合で生成されていると考えられる。したがって, その構造式は,
