[問題] 次の文を読んで下の各問いに答えなさい。必要があれば以下の値を使用してもよい。, 原子量において, H:1.0, Na:23.0, S:32.1, Fe:55.8, Cu:63.5, Pb:207.2, log102 = 0.301, log103 = 0.477, log105 = 0.699 また, 答の数値は有効数字2桁とする。
あるガラスに含まれる金属元素を分析するために, 以下の実験を行った。ただし, このガラスは, Pb2+, Cu2+, Fe2+, Na+ を金属イオンとして含むことがわかっている。
[実験1] ①細粉化したガラス1.0 g を白金るつぼにとり, 50%硫酸 8ml と46%フッ化水素酸 8ml を白金るつぼに加えた。次にケイ素をフッ化物として揮発させるため, 300℃で1時間加熱した。白金るつぼを冷やし, 蒸留水と希硫酸を加えたところ, 白色沈殿Aを得た。沈殿をろ過した後, ろ液の全量をメスフラスコに移し, 蒸留水で50mlに希釈した。
[実験2] 実験1で調整した溶液10ml に塩酸10ml を加え, 酸性にした。②この溶液に2.0×10-3mol の硫化水素H2Sを通じたところ, 黒色の沈殿CuSを2.0×10-6mol 得た。沈殿をろ紙で回収した後, ろ液をビーカーに集め煮沸した。ピペットで硝酸を数滴加えた後, 十分量のアンモニア水を加えたところ, 赤褐色の沈殿を得た。沈殿はろ紙で集め, ろ液は以下の実験3に使用した。
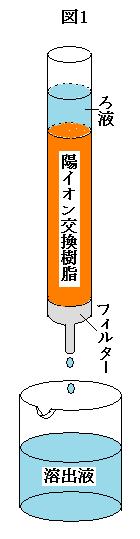
[実験3] 円筒形のカラムに, スルホ基(-SO3H)をもった十分量の陽イオン交換樹脂を詰め, カラムの上から十分量の塩酸と蒸留水を流し, カラムを洗淨した。次に, ③実験2で得たろ液を十分煮沸した。このろ液を冷却した後, カラムに流し, さらに20ml の蒸留水をカラムに流し, 流出液を全て回収した(図1参照)。この溶出液を1.0×10-2mol/l の水酸化ナトリウム水溶液で滴定したところ, 中和するまでに18.0ml を要した。
問1. 下線部①について, ガラスの主成分である二酸化ケイ素とフッ化水素との反応式を書きなさい。
答
問2. 白色沈殿Aは何ですか。化学式を示しなさい。
答
問3. 下線部②について, 硫化水素の全量が溶液に溶け込んだとする。このとき, 溶液中に含まれる硫化水素の全量の濃度[H2S]total は以下の式で表される。
[H2S]total = [H2S] + [HS-] + [S2-]
また, 硫化水素は以下に示す2段階の電離平衡が成り立つ。
H2S ⇄ HS- + H+ Ka1 = 1.0×10-7 [mol/l]
HS- ⇄ S2- + H+ Ka2 = 1.0×10-14 [mol/l]
[H2S]total に対する[S2-]の割合 α(= [S2-]/[H2S]total)を, 電離平衡定数 Ka1, Ka2 および[H+]を用いて表しなさい。答のみを記すこと。
答
問4. CuSとFeSの溶解度積(Ksp(CuS), Ksp(FeS))は以下の式で表される。
Ksp(CuS) = [Cu2+][S2-] = 4.0×10-38 [mol2/l2]
Ksp(FeS) = [Fe2+][S2-] = 1.0×10-19 [mol2/l2]
溶液のpHを1.0から6.0まで変えた時, Ksp(CuS)/αの値とKsp(FeS)/αの値は, それぞれどのように変化しますか。横軸にpH, 縦軸に log10(Ksp/α) をとって, グラフを描きなさい。
答
問5. 下線部②について, Fe2+が溶液中に4.0×10-4 [mol/l]存在するとき, FeSが沈殿しないpHの範囲を求めなさい。
答
問6. 下線部③について, この操作を行う理由を30字以内で記しなさい。
答
問7. ガラス1.0g 中に含まれるナトリウムイオンの重量[g]を求めなさい。
答
 (image285)
(image285)