問1の答
SiO2 + 6HF → H2SiF6 + 2H2O
●フッ化水素酸(HFの水溶液)は, ガラスの主成分の二酸化ケイ素SiO2と反応し, 揮発性のヘキサフルオロケイ酸H2SiF6を生じてガラスを溶解・腐食するので, ガラスに目盛をつけたり, くもりガラスの製造に利用される。
問2の答 PbSO4
●硫酸塩は硫酸イオンを含むイオン結晶で, 一般に無色で安定である。バリウム塩, ストロンチウム塩, 鉛(II)塩は, 水に対して難溶, カルシウム塩も溶解度が小さい。
問3の答
α = Ka1Ka2/([H+]2 + Ka1[H+] + Ka1Ka2)
●本文中の式より
[H2S]total = [H2S] + [HS-] + [S2-] …(1)
H2S ⇄ HS- + H+ Ka1 = 1.0×10-7 [mol/l] …(2)
HS- ⇄ S2- + H+ Ka2 = 1.0×10-14 [mol/l] …(3)
(2)と(3)から
Ka1 = [HS-][H+]/[H2S], Ka2 = [S2-][H+]/[HS-]
よって,
[HS-] = Ka1[H2S]/[H+], [S2-] = Ka2[HS-]/[H+] = Ka2Ka1[H2S]/[H+]2 …(4)
(1)と(4)から,
[H2S]total = [H2S] + [HS-] + [S2-]
= [H2S](1 + Ka1/[H+] + Ka2Ka1/[H+]2)
よって, α(= [S2-]/[H2S]total)は,
α = Ka2Ka1/[H+]2(1 + Ka1/[H+] + Ka2Ka1/[H+]2)
= Ka1Ka2/([H+]2 + Ka1[H+] + Ka1Ka2)
問4の答
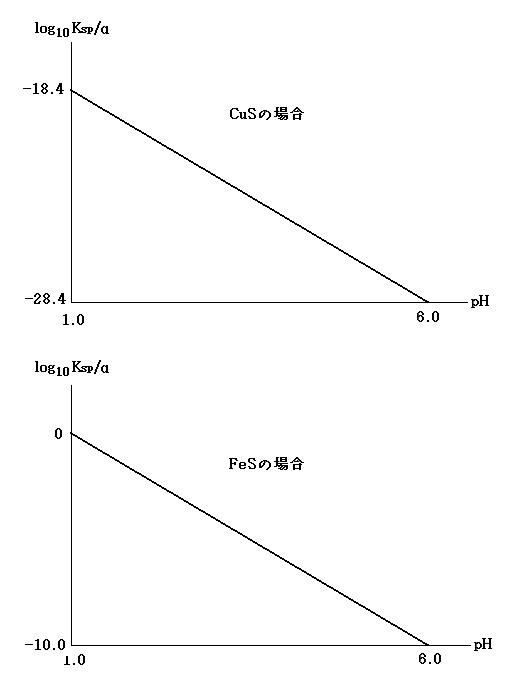 (image286)
(image286)問3の答のα = Ka1Ka2/([H+]2 + Ka1[H+] + Ka1Ka2)を使用して,
Ksp/α = (Ksp/Ka1Ka2)([H+]2 + Ka1[H+] + Ka1Ka2)
よって,
log10(Ksp/α) = log10Ksp - (log10Ka1 + log10Ka2) + log10([H+]2 + Ka1[H+] + Ka1Ka2)
CuSにおいて,
log10Ksp(CuS) - (log10Ka1 + log10Ka2) = 0.301×2 - 38 + 21 = -16.398
よって,
Ksp(CuS)/α = -16.398 + log10{[H+]2 + (1.0×10-7)[H+] + 1.0×10-21} …縦軸
pH = -log10[H+] …横軸
pH = 1 …[H+] = 10-1のとき,
Ksp(CuS)/α = -16.398 + log10{10-2 + 1.0×10-7+ 1.0×10-21} = 約 -18.4
pH = 2 …[H+] = 10-2のとき,
Ksp(CuS)/α = -16.398 + log10{10-4 + 1.0×10-9+ 1.0×10-21} = 約 -20.4
pH = 3 …[H+] = 10-3のとき,
Ksp(CuS)/α = -16.398 + log10{10-6 + 1.0×10-10 + 1.0×10-21} = 約 -22.4
pH = 4 …[H+] = 10-4のとき,
Ksp(CuS)/α = -16.398 + log10{10-8 + 1.0×10-11 + 1.0×10-21} = 約 -24.4
pH = 5 …[H+] = 10-5のとき,
Ksp(CuS)/α = -16.398 + log10{10-10 + 1.0×10-12 + 1.0×10-21} = 約 -26.4
pH = 6 …[H+] = 10-6のとき,
Ksp(CuS)/α = -16.398 + log10{10-12 + 1.0×10-13 + 1.0×10-21} = 約 -28.4
同様にして, FeSでは,
log10Ksp(FeS) - (log10Ka1 + log10Ka2) = - 19 + 21 = 2
よって,
Ksp(FeS)/α = 2 + log10{[H+]2 + (1.0×10-7)[H+] + 1.0×10-21} …縦軸
pH = 1 …[H+] = 10-1のとき,
Ksp(CuS)/α = 2 + log10{10-2 + 1.0×10-7+ 1.0×10-21} = 約 0.0
pH = 2 …[H+] = 10-2のとき,
Ksp(CuS)/α = 2 + log10{10-4 + 1.0×10-9+ 1.0×10-21} = 約 -2.0
pH = 3 …[H+] = 10-3のとき,
Ksp(CuS)/α = 2 + log10{10-6 + 1.0×10-10 + 1.0×10-21} = 約 -4.0
pH = 4 …[H+] = 10-4のとき,
Ksp(CuS)/α = 2 + log10{10-8 + 1.0×10-11 + 1.0×10-21} = 約 -6.0
pH = 5 …[H+] = 10-5のとき,
Ksp(CuS)/α = 2 + log10{10-10 + 1.0×10-12 + 1.0×10-21} = 約 -8.0
pH = 6 …[H+] = 10-6のとき,
Ksp(CuS)/α = 2 + log10{10-12 + 1.0×10-13 + 1.0×10-21} = 約 -10.0
問5の答 pH ≦ 3.2
●Fe2+が溶液中に4.0×10-4 [mol/l]存在するとき, FeS沈殿直前の硫化物イオンの濃度は, Ksp(FeS) = [Fe2+][S2-] = 1.0×10-19 [mol2/l2]から,
[S2-] = 1.0×10-19/(4.0×10-4) = 0.25×10-15 = 2.5×10-16 [mol/l]
したがって, FeSが沈殿しない場合の硫化物イオンの範囲は
[S2-] ≦ 2.5×10-16 [mol/l]
一方, [S2-] = 2.5×10-16 [mol/l]のときのα値は, 実験2の下線部②において,
[H2S]total = (2.0×10-3 - 2.0×10-6)/0.02 = 0.100 - 0.0001 = 0.0999 [mol/l]
α = [S2-]/[H2S]total = 2.5×10-16/0.0999 = 2.5025×10-15
α ≦ 2.5025×10-15
よって,
Ksp(FeS)/α ≧ 1.0×10-19/2.5025×10-15=約4.0×10-5
log10(Ksp(FeS)/α) ≧ -5 + 0.301×2 = -4.398
問4の答のグラフ pH~log10(Ksp(FeS)/α) において, log10(Ksp(FeS)/α) = m・pH + n とすると, この直線は, (1, 0)と(6, -10)をとおるので
0 = m + n
-10 = 6m + n
よって,
m = -2, n = 2
よって,
log10(Ksp(FeS)/α) = -2pH + 2
log10(Ksp(FeS)/α) = -4.398において, pH値は
-4.398 = -2pH + 2
よって, pH = 3.199 = 3.2
pH ≦ 3.2
問6の答
Na+と樹脂中のH+のイオン交換のためにNH4+を除去する。
問7の答 0.021 g
●実験3において, スルホ基(-SO3H)をもった陽イオン交換樹脂に, 実験2後のろ液をとおすと, 次の式のように溶出液は酸性になっている。
-SO3H + Na+ → -SO3Na + H+ …(1)
水酸化ナトリウム水溶液を加えると, 次のように中和反応が生じる。
H+ + NaOH → H2O + Na+ …(2)
(1)と(2)から, ナトリウムイオンの物質量は, 中和反応に要した水酸化ナトリウムの物質量と同値であるから,
1.0×10-2×18/1000 = 1.8×10-4 mol
実験1において蒸留水で希釈した50mlの溶液を, 実験2で10ml使用しているので,
1.8×10-4×(50/10) = 9.0×10-4 mol
よって, ナトリウムイオンの質量[g]は,
23.0×9.0×10-4 = 0.0207 = 0.021g