問1の答 K殻:2個, L殻:8個, M殻:13個
●原子番号26の鉄原子Feは原子核の周囲に26個の電子を持っている。酸化鉄(III) Fe2O3中の3価の鉄イオンFe3+は原子核の周囲に26 - 3 = 23個の電子を持っている。Fe3+の23個の電子は, 原子核に一番近いところにあるK殻の 1s電子軌道に2個, 次にL殻の2s電子軌道に2個, 2p電子軌道に6個, 最後にM殻の3sに2個, 3Pに6個, 3dに5個配置されている(水素原子模型)。簡潔にまとめると次のようになる。
Fe3+ : 1s22s22p63s23p63d5
●原子内の電子のエネルギー準位を示す殻は, 原子核を中心にして, K殻(主量子数n = 1に相当する), L殻(n = 2), M殻(n = 3), N殻(n = 4), O殻(n = 5), P殻(n = 6), Q殻(n = 7)に分けられる。原子内の各殻に含まれる最大電子数は2n2で求まる。
●原子内の各殻に含まれる電子軌道(s:sharp, p:principal, d:diffuse, f:fundamental)とその軌道中の基底状態での最大電子個数は次のようになる。
K殻(n=1) : 1s(l = 0)…2個(1つのs軌道に電子が2個入る。球状の形) なお, l(エル)は方位量子数を意味する。
L殻(n=2) : 2s(l = 0)…2個
2p(l = 1)…6個(px, py, pzの3つのp軌道にそれぞれ電子が2個入る。アレイ状の形)
なお, px = p+1, py = p-1, pz = p0:添え数字は磁気量子数mlを表す。
M殻(n=3) : 3s(l = 0)…2個
3p(l = 1)…6個
3d(l = 2)…10個(dz2, dzx, dyz, dxy, dx2-y2 の5つのd軌道にそれぞれ電子が2個入る。形複雑)
なお, dz2 = d+2, dzx = d+1, dyz = d0, dxy = d-1, dx2-y2 = d-2:添え数字は磁気量子数ml
N殻(n=4) : 4s(l = 0)…2個
4p(l = 1)…6個
4d(l = 2)…10個
4f(l = 3)…14個(f+3, f+2, f+1, f0, f-1, f-2, f-3の7つのf 軌道にそれぞれ電子が2個入る。形複雑)
なお, fの添え数字は磁気量子数mlを表す。
●各電子軌道s, p, d, f に含まれる最大電子数は2[2・l(エル) + 1]で求まる。
○主量指数:n = 1, 2, 3, … (正の整数)
○主量指数nと方位量指数l(エル)との関係…0≦l≦n-1
○方位量指数l(エル)と磁気量子数mlとの関係…-l≦ml≦l
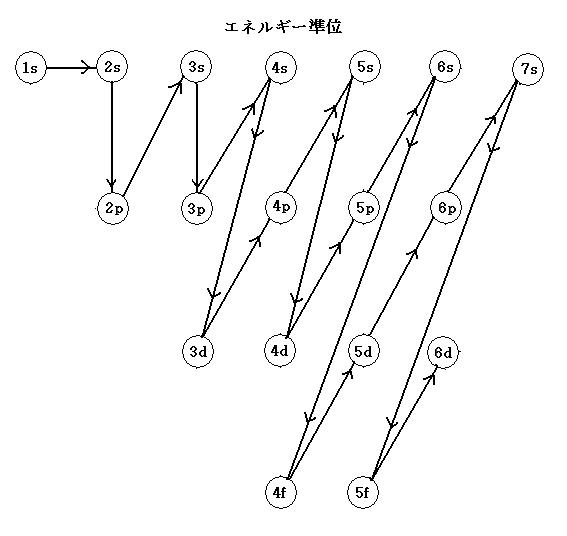
●エネルギー準位は, 通常, 主量子数(n)が大きくなるほど高く, 主量子数(n)が同じ値の場合には, 方位量子数(l:エル)の値が大きくなるほど高い。しかし, n≧3の場合は, 高低の逆転が生じる(下図参照)。
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d
 (image281)
(image281)問2の答 2.1
1mol当たりの体積を考慮すると, 鉄原子Feの体積VFeは, 密度7.87 g・cm-3と原子量55.8(1mol当たり質量gの数値に相当)より
VFe = 55.8/7.87 = 7.0902 cm3
酸化鉄(III)Fe2O3の体積VFe2O3は, 密度5.24 g・cm-3と式量:(55.8×2 + 16×3) = 159.6(1mol当たり質量gの数値に相当)より
VFe2O3 = 159.6/5.24 = 30.458 cm3
Fe2O3のFe 1mol当たりでは,
V'Fe2O3 = VFe2O3/2 = 15.229 cm3
よって, aは
a = 15.229/7.0902 = 2.1(答)
問3の答
FeO(OH)の生成 : Fe(OH)3 → FeO(OH) + H2O
Fe2O3の生成 : 2Fe(OH)3 → Fe2O3 + 3H2O
問4の答
4Fe + 2H2O + 3O2 → 4FeO(OH)
Fe → Fe2+ + 2e- … (1) 2H2O + O2 + 4e- → 4OH- … (2)
Fe2+ + 2OH- → Fe(OH)2 … (3)
4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3 … (4)
問3の答の式 Fe(OH)3 → FeO(OH) + H2O …(5)
●(1)〜(3)式において, Fe2+, e-およびOH-を消去するようにまとめると
2Fe + 2H2O + O2 → 2Fe(OH)2
[まとめ]
2Fe → 2Fe2+ + 4e-
2H2O + O2 + 4e- → 4OH-
+) 2Fe2+ + 4OH- → 2Fe(OH)2
―――――――――――――――
2Fe + 2H2O + O2 → 2Fe(OH)2
●上式と(4)式において, Fe(OH)2を消去するようにまとめると
4Fe + 6H2O + 3O2 → 4Fe(OH)3
[まとめ]
4Fe + 4H2O + 2O2 → 4Fe(OH)2
+) 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3
――――――――――――――――――――
4Fe + 6H2O + 3O2 → 4Fe(OH)3
●上式と問3の答の式(5)において, Fe(OH)3を消去するようにまとめると
4Fe + 2H2O + 3O2 → 4FeO(OH)
[まとめ]
4Fe + 6H2O + 3O2 → 4Fe(OH)3
+) 4Fe(OH)3 → 4FeO(OH) + 4H2O
――――――――――――――――――
4Fe + 2H2O + 3O2 → 4FeO(OH) : (答)
問5の答 3.2×10-4g
火星の大気圧 610Pa中の酸素分圧は,
610×0.0013 = 0.793Pa
ヘンリーの法則 「溶解度の小さい気体では, 一定温度で一定量の液体に溶解する気体の質量は, その気体の圧力(混合気体の場合は分圧)に比例する」から, 火星大気において, 水1.00×103L中に溶解する酸素の溶質gは,
(4.06×10-2)×[0.793/(1.01×105)]×(1.00×103) = 3.2×10-4g(答)
問6の答 1.2×10-3g
問4の答から,
4Fe + 2H2O + 3O2 → 4FeO(OH)
上式から, 1molのO2から(4/3)molのFeO(OH)が生成するので, 問5の答 3.2×10-4g と FeO(OH)の式量 (55.8 + 16×2 + 1) = 88.8, 酸素の分子量32を使用して,
88.8×(3.2×10-4/32)×(4/3) = 11.84×10-4 = 1.2×10-3g(答)