問1の答 ハロゲン 1価の陰イオン
ヒント
●ハロゲン元素の原子は, 元素記号をXとすると, 次式のように1個の電子e- を受け取り, 1価の陰イオンX-になる。
X + e- → X-
●ハロゲン元素の原子は, 基底状態の電子配置では最外殻に7個の電子を有しているので, 外部の相手から1個の電子を取り入れて希ガス元素の原子の電子配置を取る(相手を酸化する)傾向がある。
(例) 塩素の場合:
1s22s22p63s23p5(塩素Cl の電子配置) + e- →
1s22s22p63s23p6(塩化物イオンCl- の電子配置…希ガスArの電子配置)
問2の答 F > Cl > Br > I (またはF2 > Cl2 > Br2 > I2)
ヒント
●ハロゲン元素の原子は, 基底状態の電子配置では最外殻に7個の電子を有しているので, 外部の相手から1個の電子を取り入れて希ガス元素の原子の電子配置を取る(相手を酸化する)傾向がある。
●ハロゲン元素の原子の電子を取り入れる強さは, 主として, 原子の中心と最外殻の電子軌道との距離およびその間の電荷の遮蔽効果(電子の数)に依存する。
F(距離:0.72Å, 電子数:4), Cl(距離:0.99Å, 電子数:12), Br(距離:1.14Å, 電子数:30),
I(距離:1.33Å, 電子数:48)
問3の答 (ア)~(エ)…7, (a)ヘリウム (b)ネオン (c)アルゴン (d)クリプトン
ヒント
●ハロゲン元素の原子は, 基底状態の電子配置では最外殻に7個の電子を有し, 内殻は希ガスの安定な電子配置をしている。
(例) 塩素の場合: 1s22s22p63s23p5……1s22s22p6(ネオン電子配置)3s23p5(最外殻電子配置)
問4の答 (1)臭素 (2)塩素 (3)ヨウ素 (4)フッ素
ヒント
●フッ素 F2…融点:-220℃, 沸点:-188℃ 塩素 Cl2…融点:-101℃, 沸点:-34℃
臭素 Br2…融点:-7℃, 沸点:59℃ ヨウ素 I2…融点:114℃, 沸点:184℃(揮発性で加熱すると昇華
して紫色の蒸気となる)
問5の答 (1)臭素 (2)フッ素 (3)ヨウ素 (4)塩素
ヒント
○フッ素の製法
ホタル石(主成分:CaF2)や氷晶石(主成分:Na3AlF6)に含まれるフッ素をカリウム塩(KF・1.8HF~KF・2.5HF)として溶融し電気分解する。陽極に発生。
2KF → 2K + F2 または 2HF → H2 + F2
○塩素の製法
海水や岩塩から得られるNaCl塩を溶融して電気分解する。陽極に発生。
2NaCl → 2Na + Cl2
○臭素の製法
海水などに含まれる臭素イオンをマグネシウム塩(MgBr2)にしてその塩を硫酸酸性の酸化マンガン(IV)で酸化する。
MgBr2 + MnO2 + 2H2SO4 → MgSO4 + MnSO4 + 2H2O + Br2
○ヨウ素の製法
海草などに含まれるヨウ素の成分をカリウム塩(KI)にしてその塩を硫酸酸性の酸化マンガン(IV)で酸化する。
2KI + MnO2 + 3H2SO4 → 2KHSO4 + MnSO4 + 2H2O + I2
問6の答
(1)塩素, フッ素 2KBr + Cl2 → 2KCl + Br2 2KBr + F2 → 2KF + Br2
(2)臭素 Br2 + H2O → HBr + HBrO AgNO3 + HBr → AgBr + HNO3
(3)塩素 CaCl(ClO)・H2O + 2HCl → CaCl2 + 2H2O + Cl2
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
(4)フッ素 2F2 + 2H2O → 4HF + O2 6HF + SiO2 → H2SiF6 + 2H2O
AgNO3 + HF → AgF(溶解) + HNO3
(5)塩素 MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
(6)ヨウ素 I2 + H2O → HI + HIO AgNO3 + HI → AgI + HNO3
(7)塩素 Cl2 + H2O → HCl + HClO AgNO3 + HCl → AgCl + HNO3
問7
(1)の答
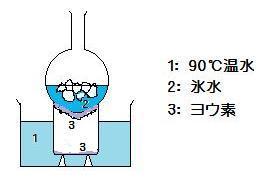 (image163)
(image163)[説明] ビーカー底の固体のヨウ素は昇華し紫色の気体となり冷却されたフラスコに接すると純粋の黒紫色の固体として再結晶化する。
ヒント
昇華は, 固体を加熱すると液化しないで直接気体になる物理変化を意味しており, ショウノウ, ナフタリン, 固体炭酸(ドライアイス)などの分子性結晶によくみられる。
(2)の答 0.105 mol/L
ヒント
②式を使って三ヨウ化物イオンI3-のモル濃度を求めると
K = [I3-]/{[I2][I-]} = [I3-]/{[1.30×10-3][0.100]} = 8.0×102
∴ [I3-] = 0.104 mol/L
したがって, I3-が0.104 mol/Lできるためには, 下式から
I2 + I- → I3-
I2が0.104 mol/L消費されたことになる。平衡状態で残っているI2は1.30×10-3mol/Lなので, 最初に加えたヨウ素の物質量は
0.104 + 1.30×10-3 = 0.1053 = 0.105 mol/L(答)
(3)の答 水層ヨウ素: 9.52×10-5 mol 四塩化炭素層ヨウ素:7.70×10-4 mol
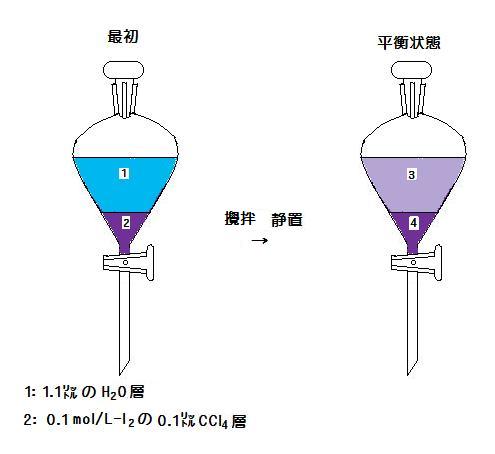
上図(image164)の分液漏斗中で, 最初2の四塩化炭素0.1L中のヨウ素の物質量は
0.100×(100/1000) = 0.01 mol
平衡状態において,
ヨウ素が x mol だけ水層に移動したとすると, 水層3では①式の平衡状態になる。
I2 + I- ⇄ I3- …①
ここで, I2のモル濃度は, I3-の物質量を y mol とすると
(x - y)×(1/1.1) mol/L
したがって, ②の平衡定数Kから
K = [I3-]/{[I2][I-]} = {y×(1/1.1)}/[{(x - y)×(1/1.1)}(0.12)] = 8.0×102 …(a)
CCl4層4のI2のモル濃度は,
(0.01- x)×(1000/100) mol/L
③の分配係数KDから
KD = [I2]t/[I2]w = {(0.01- x)×(1000/100)}/{(x - y)×(1/1.1)} = 89.0 …(b)
(a)式を変形すると,
y = 96(x - y) よって y = 96x/97 …(a')
(b)式を変形すると,
10(0.01- x) = (89/1.1)(x - y) …(b')
(a')を(b')に代入してx値を求めると
x = 0.0092301 mol
(a')から y = 0.0091349 mol
平衡での水層のヨウ素は x - y = 9.52×10-5 mol (答)
四塩化炭素層では 0.01 - 0.0092301 =7.70×10-4 mol (答)