[問題]. 電池に関する次の本文について下の各問いに答えなさい。答の数値は有効数字三桁とする。必要あれば亜鉛の原子量:65.4, ファラデェ-定数:9.65×104 C/molを用いなさい。
化学電池は酸化還元反応の化学エネルギーを電気エネルギーに変換する装置である。負極では酸化反応で電子を外の回路に放出し, 正極では還元反応で回路から流入して来る電子を受け取っている。
化学電池を実用的にするためには, 少量の酸化還元物質で多くの電気量が得られること, 起電力が大きく電流取り出しで電圧低下が少ないこと, 自己放電の少ないこと, 内部抵抗が小さいこと, 安価であることなどが条件となる。腕時計やカメラの露出計などに用いられるボタン形のアルカリ系酸化銀電池は次の概略図(image157)で表わされる。
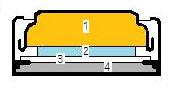 (image157)
(image157)ここで, 1:負極…材料にはアマルガム化した亜鉛(水銀との合金)粉末と電解液との混合物 2:電解液…水酸化カリウム濃厚水溶液 3:セパレーター…セロハンやポリプロピレンなどのフィルム 4:正極…材料には酸化銀粉末と導電剤である黒鉛との混合物。 負極と電解液との接触面では水素発生が生じないように工夫されている。
問1. 次の(ア)〜(オ)には化学式(イオン式も含む), (a)と(b)には数字を書き入れなさい。
アルカリ系酸化銀電池の正極および負極の主反応は次の反応式で書かれる。
正極:Ag2O + (ア) + 2e- → (a)(イ) + (b)OH-
負極:Zn + 2(ウ) → (エ) + 2e-
(エ)は水に不溶であるが, すぐに次式に示すような反応を起こして電解液に溶ける。
(エ) + 2OH- → (オ)
答
問2. アルカリ系酸化銀電池で0.150mAの電流を720時間放電した。このときの負極の亜鉛は何g消費されますか。
答
問3. 正極のAg2Oと負極で生成される(エ)は大過剰のアンモニア水に溶けて錯イオンを形成する。形成されるの錯イオンの構造式を立体的に書きなさい。
答