問1の答
(ア:H2O) (イ:Ag) (ウ:OH-) (エ:Zn(OH)2) (オ:[Zn(OH)4]2- …テトラヒドロキソ亜鉛(II)酸イオン)
(a:2) (b:2)
[ヒント] 電気製品には小型でも大型でもそれに対応するあらゆる種類の電池が内蔵されている。それらの電気製品の機能は電池の性能に依存していると言っても過言ではない。さらに自動車などに使われる燃料電池などが積極的に開発・実用化されている。
電池には, 化学電池のほかに, 化学変化に基づかないところの太陽電池, 濃淡電池, 熱電池, 原子力電池などがある。
●化学電池
○ボルタ電池 (-)Zn|H2SO4aq|Cu(+) 起電力約1V
化学実験でよく使われ, 基本的な電池のひとつである。基礎概念の酸化還元反応, イオン化傾向, 分極, 減極剤などが理解されやすい。
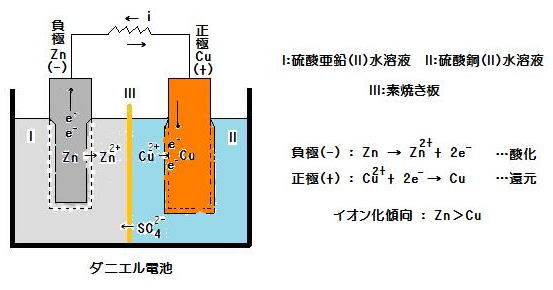
○ダニエル電池 (-)|Zn|ZnSO4aq|CuSO4aq|Cu(+) 起電力約1.1V(半電池の組合せで決まる)
電極と電解質溶液との一対から成る半電池のZn|Zn2+ および Cu|Cu2+ との組み合わせで構成されている(Zn|Zn2+ と Cu|Cu2+ に含まれる共通のイオンSO42-は省いて記述する)。(image160)
[半電池の標準電極電位の決め方]
一般に標準水素電極 H+|H2・Pt (25℃, 1mol/Lの塩酸HCl中に白金黒付き白金Ptを浸し1atmの水素ガスH2をPtに接触させる)を使用する。
任意の半電池の標準電極電位(電解質の濃度1mol/L, 25℃)は, 標準水素電極(起電力を0Vとする)を半電池の電極に接続し測定する。標準電極電位の小さいほど半電池の電極は電子を放出しやすく, したがって, 負極になりやすい。逆に電位の大きいほど半電池の電極は電子を受け取りやすく, したがって, 正極になりやすい。このことは金属など(電極)のイオン化傾向の大小にも対応している。
(例) ダニエル電池において,
半電池のZn|Zn2+ :標準電極電位-0.763V … 負極, 電子放出, Znのイオン化傾向大
半電池のCu|Cu2+ :標準電極電位0.337V … 正極, 電子受取, Cuのイオン化傾向小
ダニエル電池の起電力…0.337 - (-0.763) = 1.10V
○マンガン乾電池(実用一次電池…再生不可) (-)Zn|ZnCl2 aq, NH4Cl aq|MnO2・C(+)
安価, 一般的な電気製品に応用
○アルカリマンガン乾電池(実用一次電池) (-)Zn|KOHaq|MnO2・C(+)
比較的安価, 一般的な電気製品に応用
○ リチウム電池(実用一次電池) (-)Li|フッ素の化合物|(CF)nまたはMnO2(+) 起電力約3.0V
起電力大, 保持時間大…心臓ペースメーカー, カメラ, 時計, ブザー, 電卓などに応用
○ 空気電池(実用一次電池) (-)Zn|NH4Claq 空気|(O2)(+) 起電力約1.2V
放電時の電圧安定で保持時間大…補聴器, 腕時計, トランシーバーなどに応用
○ 酸化銀電池(銀電池)(実用一次電池) (-)Zn|KOHaq|Ag2O(+) 約1.5V
エレクトロニクス機器などの電源に応用
○鉛蓄電池(実用二次電池…充電再生) (-)Pb|H2SO4aq|PbO2・Pb(+) 起電力約2.1V
可逆反応が利用されている…自動車用バッテリーなどに応用。
[放電]…電解液の約30%希硫酸濃度が小さくなり密度減少
負極(-) Pb + SO42- → PbSO4 + 2e- 正極(+) PbO2 + 4H+ + SO42- + 2e- → PbSO4 + 2H2O
[充電}…放電時の逆状態(元にかえる)
負極(-) PbSO4 + 2e- → Pb + SO42- 正極(+) PbSO4 + 2H2O → PbO2 + 4H+ + SO42- + 2e-
○ リチウムイオン電池(実用二次電池) (-)LiC6|Li塩|LiCoO2(+) 起電力約3.6V
起電力大, 内部抵抗小…ビデオカメラ, パソコン, 携帯電話などに応用
○ ニッケル・水素電池(実用二次電池) (-)MH(水素吸蔵合金)|KOHaq|NiO(OH)(+) 起電力約1.2V
長時間放電可能…液晶テレビ, デジタルカメラ, ステレオなどに応用
○ ニッケル・カドミウム電池(実用二次電池) (-)Cd|KOHaq|NiO(OH)(+) 起電力約1.2V
衝撃や振動などに強く保持時間大…シェーバー, ラジオ, ストロボなどに応用
[燃料電池]…自動車の燃料電池や家庭の自家発電燃料電池などに応用
○ リン酸型燃料電池 (-)Pt・H2|H3PO4aq|O2・Pt(+)
負極(-) 2H2 → 4H+ + 4e- 正極(+) O2 + 4H+ + 4e- → 2H2O
○ アルカリ型燃料電池 (-)Pt・H2|KOHaq|O2・Pt(+)
負極(-) 2H2 + 4OH- → 4H2O + 4e- 正極(+) O2 + 2H2O + 4e- → 4OH-
1つにまとめた反応式はリン酸型燃料電池でもアルカリ型燃料電池でも次のようになる :
2H2 + O2 → 2H2O
●太陽電池…化学反応を利用する化学電池とは異なり, 太陽の光エネルギーを電気エネルギーに変換する装置である。
具体的には, n型半導体(ケイ素Siに族番号が14より大の微量のヒ素Asなどを加えたもの)とp型半導体(ケイ素Siに族番号が14より小の微量のホウ素Bなどを加えたもの)を接合して作られている。
太陽電池の接合部領域まで光が当たると, 光量子の作用により, 発生した電子がp-n接合部のエネルギー障壁を超えてn型半導体へ移動する。同時に生じる正孔(ホール:電子のぬけた正電荷の孔)はp型半導体へ移動する。その結果として接合部に光電効果の起電力が生じることになる。

(image159)
問2の答 0.132 g
[ヒント]
放電での電気量 Qクーロンは
Q = (0.150×10-3)×(720×60×60) = 388.8 [C]
上のQ値に相当する電子の物質量mol は, ファラデェ-定数:9.65×104 [C/mol]から
388.8/(9.65×104) = 40.2902×10-4 [mol]
問1の負極での反応式: Zn + 2OH- → Zn(OH)2 + 2e-より, 1molの亜鉛から2molの電子が放出,
よって, 亜鉛の質量gは, 原子量65.4から
65.4×(40.2902×10-4/2) = 0.132 g (答)
問3の答
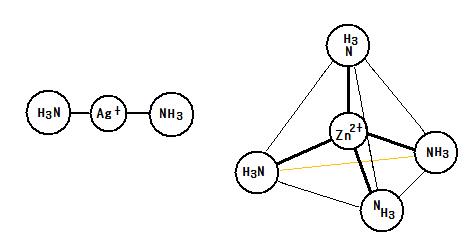
左:ジアンミン銀(I)イオン[Ag(NH3)2]+ …直線形イオン
右:テトラアンミン亜鉛(II)イオン[Zn(NH3)4]2+ …正四面体形イオン
(image158)
[ヒント]
酸化銀Ag2Oと水酸化亜鉛Zn(OH)2が大過剰のアンモニア水と反応すると次式のように錯イオンのジアンミン銀(I)イオン[Ag(NH3)2]+とテトラアンミン亜鉛(II)イオン[Zn(NH3)4]2+が生じる。
Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]+ + 2OH-
Zn(OH)2 + 4NH3 → [Zn(NH3)4]2+ + 2OH-