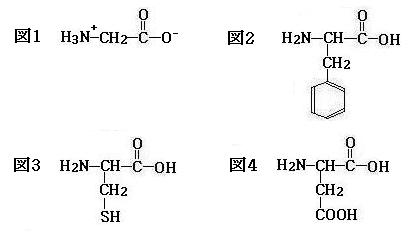
問1の答(下図1) [下の(カ)を参照 示性式(双性イオン):H3N+-CH2-COO-]
問2の答(下図2) [下の(エ)と(カ)を参照 示性式:H2NCH(CH2C6H5)COOH]
問3の答(下図3) [下の(オ)と(カ)を参照 示性式:H2NCH(CH2SH)COOH]
問4の答(下図4) [下の(カ)と(キ)を参照 示性式:H2NCH(CH2COOH)COOH]
 (image416)
(image416)(ア) (1)より グルタチオンとアスパルテームの等モル混合物を加水分解 → G, H, I, J, K, L
よって,
グルタチオン + 2H2O
→ HOOCCH(NH2)CH2CH2-COOH + H2N-CH(CH2SH)-COOH + H2N-CH2-COOH
アスパルテーム → H2NCH(CH2COOH)-COOH + H2N-CH(CH2C6H5)-COOH + HO-CH3
(イ) (2)と(ア)の反応式より, 分解で生じる各生成物の示性式は次のようになる。
●GとH(光学異性体なし):H2N-CH2-COOH, HO-CH3
●I, J, K, L(光学異性体…C*が不斉炭素原子):
HOOCC*H(NH2)CH2CH2-COOH, H2N-C*H(CH2SH)-COOH, H2NC*H(CH2COOH)-COOH,
H2N-C*H(CH2C6H5)-COOH
(ウ) (3)と(イ)より, 常温・常圧で液体の化合物(G)は CH3OH
G : CH3OH
よって,
H : H2NCH2COOH
(エ) (4)においての橙黄色の変色は, 化合物 I 中のベンゼン環の水素原子がニトロ基で置換したことによる。よって, (イ)を参照して, ベンゼン環を有する化合物 I は
I : H2NCH(CH2C6H5)COOH
(オ) (5)においての黒色沈殿はPbSであり, したがって, (イ)を参照して, イオウを有する化合物 J は
J : H2NCH(CH2SH)COOH
(カ) アミノ酸は分子中に酸性のカルボキシル基-COOHと塩基性のアミノ基-NH2をもつ両性化合物で双性イオン(分子内で中和反応して正と負の電荷をもつイオン)を生じる。
アミノ酸の分子は, 酸性水溶液中ではアミノ基と水素イオンが反応して陽イオンになり, 電気泳動において, 陰極に移動する。塩基性水溶液(アルカリ性溶液)中ではカルボキシル基と水酸化物イオンが反応して陰イオンになり, 電気泳動において, 陽極に移動する。
アミノ酸の分子は, 水溶液のpH値を調整すると, 分子内で正と負の電荷が打ち消され, 電気泳動が見られなくなる。このpH値を等電点という。
(6)の電気泳動の等電点のpHにおいて, KとLの場合がH, I, J のいずれの場合よりも小さかった。言いかえると, KとLの場合が, 水溶液のより酸性側で等電点を生じることを意味している。
したがって, 化合物 H~L の各水溶液において,
H2N-CH2-COOH…(H) は, 次の平衡状態を生じる。
H2N-CH2-COOH ⇄ H3N+-CH2-COO-
上の平衡で, 双性イオン内の電荷は打ち消され, 電気泳動が見られなくなる。この水溶液は中性で, そのpH値は
pH ≒7.0 …H
上のHの記述を参照して, H2N-CH(CH2SH)-COOH…(J) と H2N-CH(CH2C6H5)-COOH…(I) も, 同様に,
pH ≒7.0 …I, J
一方, KとL (示性式:HOOC-CH(NH2)CH2CH2-COOH または H2N-CH(CH2COOH)-COOH) は, 次の平衡状態を生じる。
HOOC-CH(NH2)CH2CH2-COOH ⇄ -OOC-CH(NH3+)CH2CH2-COO- + H+ …(a)
H2N-CH(CH2COOH)-COOH ⇄ H3N+-CH(CH2COO-)-COO- + H+ …(b)
いずれも, 水素イオン H+が生じ, 水溶液は酸性で, pH<7.0 となる。また, 双性イオン内の電荷は打ち消されず負となる。双性イオン内の正と負の電荷を打ち消して等電点にするためには, さらに, 水溶液を酸性にして, 上述の(a)と(b)の平衡を左側へ移動させること, すなわち, pH値を 7.0 よりさらに小さくする必要がある。このことは, KとLの場合, 等電点のpHはH, I, J のいずれの場合よりも小いことを意味する。
(キ) K は, (ア)~(カ)から, その示性式は,
HOOC-CH(NH2)CH2CH2-COOH
その式量:12×5 + 1×9 + 16×4 + 14 = 147, 炭素の組成%は, (60/147)×100 = 40.8%
または
H2N-CH(CH2COOH)-COOH
その式量:12×4 + 1×7 + 16×4 + 14 = 133, 炭素の組成%は, (48/133)×100 = 36.1%
(7)より, 化合物 K 1.00g中の炭素の質量は, 発生した 1.32g の二酸化炭素から
1.32×(C/CO2) = 1.32×(12/44) = 0.36g
よって, 炭素の組成%は,
(0.36/1.0)×100 = 36%
よって, Kの示性式は
K : H2NCH(CH2COOH)COOH
よって,
L : HOOCCH(NH2)CH2CH2COOH