[栤戣] 師偺暥復傪撉傒, 埲壓偺栤1乣6偵摎偊側偝偄丅
丂昁梫偁傟偽師偺抣傪巊梡偟側偝偄丅[尨巕検] H=1.00, C=12.0, O=16.0, Mg=24.3, Al=27.0, Si=28.1, Cl=35.5, Ca=40.1, Fe=55.8, [傾儃僈僪儘掕悢] 6.0亊1023 mol-1, [婥懱掕悢] 8.3Pa丒m3丒K-1丒mol-1 = 0.082atm丒L丒K-1丒mol-1
丂働僀慺偼敿摫懱偲偟偰偺惈幙傪傕偪, 僐儞僺儏乕僞傗懢梲揹抮偺嵽椏偲偟偰巊傢傟傞丅僐儞僺儏乕僞偺廤愊夞楬偵偼, 偱偒傞偩偗弮悎偱戝偒側働僀慺偺寢徎偑昁梫偱偁傝, 埲壓偺傛偆側曽朄偱惢憿偝傟偰偄傞丅
丂SiO2傪庡惉暘偲偡傞働僀愇傪僐乕僋僗偲偲傕偵壛擬偟, 働僀慺偵娨尦偡傞丅摼傜傟偨働僀慺偼, 揝, 傾儖儈僯僂儉, 僇儖僔僂儉側偳偺晄弮暔傪0.1亾掱搙娷傓丅師偵, 晄弮暔傪娷傓働僀慺傪墫壔悈慺(HCl)偲斀墳偝偣, 僩儕僋儘儘僔儔儞(SiHCl3丗暒揰31.8亷)偲偟偨屻, 忲棷偵傛傝惛惢偡傞丅
丂嘆惛惢偟偨SiHCl3傪悈慺(H2)偱娨尦偟, 弮悎側働僀慺傪摼傞丅偙偺働僀慺偼旝嵶側寢徎偺廤傑傝偱偁傞偨傔, 嘇擇巁壔働僀慺偺傞偮傏偺拞偱梈夝偟, 偙偺拞偵庬偲側傞寢徎傪擖傟偰, 偙傟傪彊乆偵堷偒忋偘側偑傜椻媝偡傞偙偲偵傛傝戝偒側働僀慺偺寢徎(扨寢徎偲屇傇)傪惉挿偝偣傞丅
丂偙偺扨寢徎傪敄偄斅忬偵愗傝弌偟, 婎斅偲偟偰梡偄傞丅僐儞僺儏乕僞梡偺夞楬偵偼, 揹婥揱摫惈偺崅偄敿摫懱傕昁梫偱偁傞丅偦偺偨傔偵偼, 忋婰働僀慺偺扨寢徎(婎斅)偺忋偵, 旝検偺懠尦慺傪揧壛偟偨働僀慺偺敄枌傪懲愊偝偣傞丅
丂椺偊偽, 働僀慺偺扨寢徎傪壛擬偟偰偍偒, 偙偙偵嘊僔儔儞僈僗(SiH4)偲偲傕偵旝検偺婥懱A傪棳偡偲, 扨寢徎偺昞柺偵, 婥懱A桼棃偺旝検尦慺傪娷傫偩働僀慺偺敄枌偑晅拝偡傞丅偙偺敄枌拞偱偼, 寢徎拞偺働僀慺尨巕偺堦晹偑揧壛尦慺偲抲偒姺傢偭偰偄傞丅
丂揧壛尦慺偼, 働僀慺偵斾傋偰嵟奜妅揹巕悢偑1屌懡偔, 嘋梋偭偨揹巕偼寢徎拞傪摦偒夞傞偙偲偑偱偒傞丅偦偺偨傔偵, 弮悎側働僀慺偵斾傋偰崅偄揹婥揱摫惈傪帵偡丅揧壛尦慺偺検傪惂屼偡傞偙偲偵傛傝, 昁梫偲偡傞揹婥揱摫惈傪傕偭偨敿摫懱傪嶌傝弌偡偙偲偑偱偒傞丅
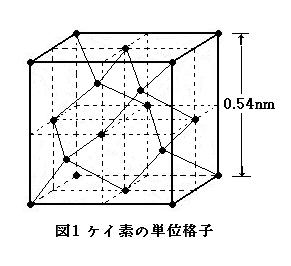
丂側偍, 働僀慺偺寢徎峔憿偼恾1偺傛偆偱偁傝, 扨埵奿巕偼堦曈偑 0.54 [nm] 偺棫曽懱偱偁傞丅崟娵偼働僀慺尨巕偺拞怱傪昞偡丅傑偨, 旝検偺尦慺傪揧壛偟偰傕, 扨懱奿巕偺戝偒偝偼曄傢傜側偄傕偺偲偡傞丅
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂
 (image434)
(image434)栤1. 壓慄嘆偺壔妛斀墳幃傪彂偒側偝偄丅
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂摎
栤2. 壓慄嘇偱, 嬥懏偺傞偮傏傪梡偄傞偙偲偼偱偒側偄丅偙偺棟桼傪1乣2峴掱搙偱弎傋側偝偄丅
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂摎
栤3. 壓慄嘊偱, 婥懱A偼戞3廃婜偺尦慺偲悈慺偺壔崌暔偱偁傞丅婥懱A偺壔妛幃傪婰偟側偝偄丅
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂摎
栤4. 恾1偺扨埵奿巕偺拞偵働僀慺尨巕偼偄偔偮娷傑傟傑偡偐丅
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂摎
栤5. 壓慄嘊偱, 昗弨忬懺偺SiH4僈僗傪 5.0[ml]棳擖偟偨偲偙傠, 3.0 [cm]亊3.0 [cm]偺婎斅偺忋偵, 働僀慺偺敄枌偑 90 [nm]懲愊偟偨丅棳偟偨SiH4僈僗偺偆偪, 壗亾偑敄枌偲偟偰懲愊偟傑偟偨偐丅桳岠悢帤1寘偱摎偊側偝偄丅側偍, 旝検偺揧壛尦慺偵偮偄偰偼柍帇偟偰傛偄丅寢壥偩偗偱側偔, 寁嶼偺夁掱傕婰偟側偝偄丅
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂摎
栤6. 壓慄嘋偱, 扨埵懱愊偁偨傝偺梋暘側揹巕偺悢偼 1.0亊1018 cm-3 偱偁偭偨丅敄枌拞偵娷傑傟傞揧壛尦慺偺尦慺悢偲働僀慺偺尨巕悢偲偺斾偼 ( 丂)丗1 偱偁傞丅僇僢僐偺拞偵擖傞悢抣傪桳岠悢帤侾寘偱摎偊側偝偄丅寢壥偩偗偱側偔, 寁嶼偺夁掱傕婰偟側偝偄丅
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂摎