[問題] 次の文章を読んで, 問1~問4に答えなさい。また, 計算の過程において|y/x|<0.01 であるとき, x + y = x と近似しなさい。なお, 問題文中の L はリットルを表わす。また, [X] は mol/L を単位とした分子またはイオン X の濃度を表わす。
アミノ酸の一種であるグリシンは, 弱塩基性のアミノ基と弱酸性のカルボキシル基を1つずつもつ。そのため, 水溶液のpHに依存して電離状態が変化し, +1, 0, -1 のいずれかの価数をもつイオンまたは分子となる。ブレンステッドとローリーの定義によれば, 価数+1のグリシンを2価の酸としてみなすことができる。
実際にグリシンの酸性水溶液を水酸化ナトリウム水溶液で滴定すると反応は2段階で進行し, 2つの電離定数(K1 = 4.5×10-3 mol/L, K2 = 1.7×10-10 mol/L) が求められる。
ところが, 正味の電荷をもたないグリシンには, アミノ基もカルボキシル基も電荷をもたない分子型と, アミノ基の電荷とカルビキシル基の電荷が互いに打ち消し合っている双生イオン(両性イオン)型の2種類が存在するため, その電離平衡は図1に示すようになる。ここで, Ka, Kb, Kc, Kd は電離定数を, G+, G±, G0, G- はそれぞれ陽イオン型, 双生イオン型, 分子型, 陰イオン型のグリシンを表わす。
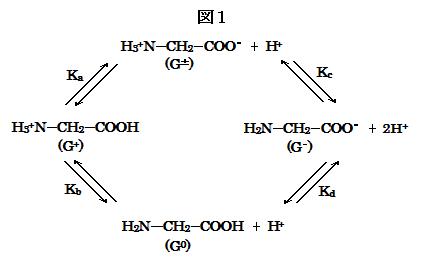 (image535)
(image535)また, 4つの電離定数 Ka, Kb, Kc, Kd は次式でそれぞれ表される。
Ka = [G±][H+]/[G+]
Kb = [G0][H+]/[G+]
Kc = [G-][H+]/[G±]
Kd = [G-][H+]/[G0]
滴定実験から得られる電離定数 K1, K2 とこれら4つの電離定数 Ka, Kb, Kc, Kd の間には K1 = ( ア ), K2 = ( イ ) の関係があるが, この2つの式から4つの電離定数の値を決定することは不可能である。
ここで, 解離基を1つしかもたないグリシンのメチルエステルの電離定数(KE = 2.0×10-8 mol/L)と( ウ )が等しいと仮定することにより, 4つの値すべて求めることができる。
得られた電離定数の値をもとに, pH<7 における双生イオン型と分子型のグリシンの濃度比を計算すると, [G±]/[G0] = ( あ )となり, 双生イオン型のグリシンが大部分を占めることがわかる。
問1 ( ア ), ( イ )の空欄を埋めて式を完成しなさい。
答
問2 ( ウ )には Ka, Kb, Kc, Kd のいずれかが入る。最も適切なものを選択し記入しなさい。
答
問3 ( あ )に入る適切な数値を有効数字2桁で記入しなさい。
答
問4 Kd の値 [mol/L] を算出し, 有効数字2桁で答えなさい。
答