[問題] 次の文章を読んで, 問1~問3に答えなさい。また, 計算の過程において|y/x|<0.01 であるとき, x + y = x と近似しなさい。なお, 問題文中の L はリットルを表わす。また, [X] は mol/L を単位とした分子またはイオン X の濃度を表わす。
2価のカルボン酸であるシュウ酸 (COOH)2 は, 水溶液中で次のように 2段階に電離する。
第1段階
HOOC-COOH ⇄ HOOC-COO- + H+
第2段階
HOOC-COO- ⇄ O-OC-COO- + H+
上式において, HOOC-COOH を H2A, HOOC-COO- を HA-, O-OC-COO- を A2- で表し, 第1段階の電離定数を K1, 第2段階の電離定数を K2 とするならば, それらの電離平衡の式はそれぞれ
K1 = [HA-][H+]/[H2A]
K2 = [A2-][H+]/[HA-]
となる。また, それらの電離定数の値はそれぞれ25℃で次のようになる。
K1 = 5.4×10-2 mol/L K2 = 5.4×10-5 mol/L
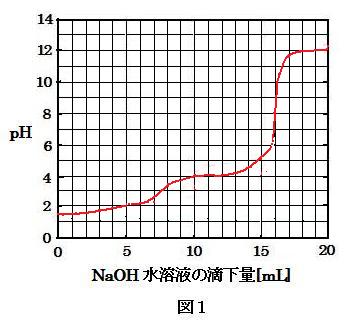
25℃, 8.0×10-2 mol/L のシュウ酸水溶液 100 mL に対して, 1.0 mol/L の水酸化ナトリウム水溶液を徐々に滴下したところ, 図1に見られるように, 8 mL および 16 mL 滴下したときをそれぞれ第1中和点, 第2中和点とする滴定曲線を得た。また, 加えた水酸化ナトリウム水溶液の量が 11 ml, 付近では pH は 4 程度で変化量は小さい。このような作用を緩衝作用と呼ぶ。
 (image534)
(image534)水溶液の pH に依存して H2A, HA-, A2- の存在比がどのように変化するかを考えよう。水溶液中に存在するシュウ酸のモル濃度を c とすると,
c = [H2A] + [HA-] + [A2-] (1)
となる。ここで, [HA-] と [A2-] を [H2A], [H+], K1, および K2 のいずれかを用いて表すと,
[HA-] = ( ア ), [A2-] = ( イ )
と表わされる。これらを式(1)に代入し整理すると,
[H2A]/c = ( ウ )
を得る。
同様に, 2種類のシュウ酸イオン [HA-] と [A2-] についても, [HA-]/c と [A2-]/c を [H+], K1, および K2 の関数として表すことが可能である。
以上から, 緩衝作用が現れている pH における濃度の比を算出すると,
[H2A] : [HA-] : [A2-] = 1 : ( あ ) : ( い )
となる。
問1 ( ア )~( ウ )の空欄を埋めて式を完成しなさい。
答
問2 ( あ ), ( い )に入る適切な数値を有効数字2桁で記入しなさい。
答
問3 下線部について, シュウ酸水溶液が緩衝作用を示す理由を150字以内で説明しなさい。
答