[問題] 次文を読んで下の各問いに答えなさい。
下の図1に示すように温度一定, 体積一定の容器中で, (1)式で示される反応を行った。ただし, 全ての成分は気体状態にあり, 理想気体とみなせる。
H2 + I2 ⇄ 2HI …(1)
ヨウ化水素が生成する右方向の反応(正反応)は発熱反応である。水素H2, ヨウ素I2, ヨウ化水素HIのモル濃度をそれぞれ[H2], [I2], [HI]と表すと, (1)式の正反応の反応速度v1は(2)式で, 逆反応の反応速度v2は(3)式で表される。
v1 = k1[H2][I2] …(2) v2 = k2[HI]2 …(3)
ただし, k1, k2は温度だけに依存する定数(反応速度定数)である。
容器中の各成分の濃度を測定し, 各測定時刻における [HI]2/[H2][I2] の値を求めた。温度の変更ならびに気体を容器に入れるのに要する時間は無視できるものとする。
[実験1] 1.0mol のH2と3.0mol のI2を容器に入れて温度T1で反応させたところ, 40秒後には容器内の各濃度が変化しなくなり, 化学平衡に到達した。そこに温度T1で2.0mol のH2を補給して再び化学平衡に到達するまで反応させた。下図2はこの実験における[HI]2/[H2][I2] の値の変化を示したものである。この実験結果から温度T1における(1)式で示される反応の平衡定数の値がわかる。これ以降の問題の解答に必要な場合は, 下図2のグラフから求めた温度T1における平衡定数の値を用いなさい。
問1. 反応開始後40秒から60秒の間のある時点において, 容器内のH2の物質量が0.8mol であった。このときの容器内のHIの物質量を求めなさい。
答
問2. 下図2の点Aにおける容器内の圧力をPとしたとき, 点B, 点Cのそれぞれにおける容器内の圧力をPを用いた式で表しなさい。
答
問3. (3)式中の温度T1における逆反応の反応速度定数k2を有効数字2桁で求めなさい。ただし, 化学平衡状態に達するまでの間, 反応の進行に伴って, (2)式に示される正反応速度は減少し, (3)式に示される逆反応速度は増加する。化学平衡状態に達すると, 正反応速度と逆反応速度は等しくなり, みかけの反応速度はゼロになる。温度T1における(1)式の正反応の反応速度定数はk1 = 48 [L/(mol・s)]である。
答
[実験2] 7.0mol のHIと1.0mol のH2を容器に入れ, 温度T1で40秒間反応させたところ①化学平衡に到達した。そこに1.0mol のH2(温度T1)を補給してさらに30秒間反応させたところ再び化学平衡に到達した。そこで, 温度T2(>T1)に上げたところ10秒後には新しい化学平衡状態に達した。
問4. 下線部①の化学平衡におけるI2の物質量を有効数字2桁で求めなさい。
答
問5. 図3は, 実験2における反応開始後3秒以降の[HI]2/[H2][I2] の変化を表そうとしたグラフである。しかし, このグラフには明らかな誤りが2つある。2つの誤りを指摘し, それぞれについてその理由を書きなさい。
答
[実験3] 3.0mol のH2と3.0mol のI2ならびに2.0mol のHIの容器に入れて温度T1で化学平衡状態に達するまで反応させた。
問6. 下に示す気体混合物のうち, 温度T1で化学平衡に達するまで反応させたときに, 各成分の物質量が実験3の場合と同じになるものを(ア)~(エ)の中から選び, 記号で答えなさい。
答
(ア) H2 4.0 mol, I2 4.0 mol の混合物
(イ) H2 1.5 mol, I2 1.5 mol, HI 1.0 mol の混合物
(ウ) H2 2.0 mol, I2 2.0 mol, HI 4.0 mol の混合物
(エ) H2 1.0 mol, I2 3.0 mol, HI 4.0 mol の混合物
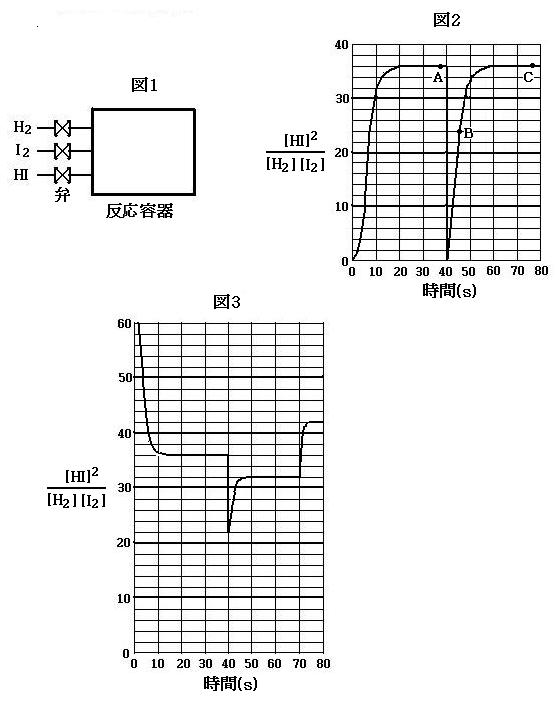 image271
image271