[問題] 次の本文を読んで下の問1と2に答えなさい。
必要があれば log2 = 0.3, log3 = 0.48 を用いなさい。また, 答の数値は有効数字2桁, X と Y において, X/Y≧1000では (X + Y)1/2 ≒ X1/2 とする。
水溶液中での弱酸AHの電離平衡は一般に次のように書ける。
AH ⇄ A- + H+ …①
AHのモル濃度mol/L(リットル)値を[AH]aq, A-では[A-]aq, H+では[H+]aqとすると, 電離平衡定数Kaは次式になる。
Ka = [A-]aq[H+]aq/[AH]aq …②
25℃でKa = 4.5×10-5 mol/Lであるとき, 0.20 mol/Lの弱酸水溶液のpHは(I)である。
この水溶液0.20 L が入っている容器に, 水に完全不溶の有機溶媒XをV L 加え密閉した。この溶液をしばらく攪拌した後に25℃で静置すると図1(image183)のように有機溶媒Xと水溶液の2層に分離した。
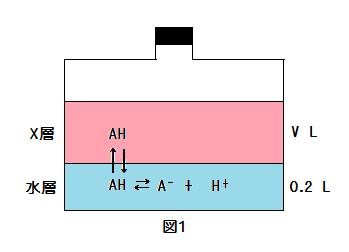
図1に示すように, Xは電離しない弱酸のみを溶かし次式が成立する。
[AH]X/[AH]aq = 8.0 …③
Xを加える前の水層のAを含む化合物(AHとA-)の物質量mol値を n0 とし, また, Xを加えた後のX層中と水層中のAを含む化合物の物質量mol値をそれぞれ n1, n2 とすると, 次式が成立する。
n0 = n1 + n2 …④
n1とn2を[AH]X, [AH]aq, [A-]aq, Vで表わすと
n1 = (ア) …⑤ n2 = (イ) …⑥
いま, V = 0.20 L とすると, pHは(II)となった。
さらに, ふた(図1の黒部分)を開けて, 0.10 mol/LのNaOH水溶液 0.20 Lを加えよく混合し静置した。そのとき, 水溶液の体積は0.40 Lとなり, pHは(III)となった。この場合, 反応は完全に行われNaOHと等量のA-が生じた。生じた水溶液は緩衝作用を示す。このとき, 弱酸AHは水中での電離とXへの溶解において溶液中の物質に影響されないとする。
有機溶媒Xが存在するときの水溶液のpHの変化に対して, X層と水層でのAを含む化合物のモル濃度比を表す次式⑦がどのように変化するかを考えてみる。
P = [AH]X/([AH]aq + [A-]aq) …⑦
PはKaと[H+]aqで表わすと
P = (ウ) …⑧
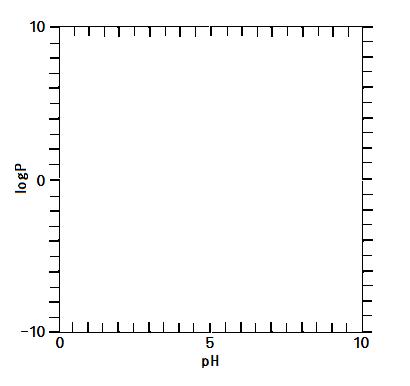
⑧式において, [H+]aqがKaに比べて非常に(a)い値の水溶液は, [H+]aqに対してP = 8となって一定になる。一方, [H+]aqがKaに比べて非常に(b)い値では, ⑧式の両辺の対数を取りpHとlogKaを用いて表した次の⑨式にそってPが変化する。
logP = (エ) + log8.0 …⑨
問1 本文中の(I)~(III)には数値, (ア)~(エ)には適した式, (a)と(b)には語句を記入しなさい。
答
問2 水溶液のpHとlogPの関係を次の図の中に実線で表わしなさい。
答
 (image184)
(image184)問3 本文の下線部分での水溶液の緩衝作用とはどういうことですか。簡潔に説明しなさい。
答