[問題] 次文を読んでから下の各問いに答えなさい。ただし, 触媒以外の反応物質はすべて気体状態で存在し, 気体は理想気体の状態方程式に従うものとする。
燃料電池用の水素製造法として, メタノールなどの燃料と水蒸気を反応させる方法がある。触媒存在下でメタノールと水蒸気は以下のように反応する。
CH3OH → CO + 2H2 …(1)
CO + H2O ⇄ CO2 + H2 …(2)
CO + 3H2 ⇄ CH4 + H2O …(3)
反応(1)は高圧条件下でなければ不可逆反応と見なしてよい。反応(2), (3)は可逆反応である。また, 反応(1)は吸熱反応, 反応(2), (3)は右方向への反応が発熱反応である。可逆反応(2), (3)の平衡定数は, 気体のモル濃度を用いて以下のように表現できる。
K2 = [CO2][H2]/[CO][H2O] …(4)
K3 = [CH4][H2O]/[CO][H2]3 …(5)
反応(2)は反応温度を( ア )と, 水素の濃度が増加する右方向へ平衡が移動する。メタンの生成を制御するためには, 反応圧力を( イ )ことが有効である。一酸化炭素の生成量を減らすには, 生成した( ウ )や二酸化炭素を反応中に分離することが有効である。しかし, ( ウ )を反応中に分離すると, 生成する水素の量は減少する。
①容積一定の容器に, メタノールと水蒸気を 2:3 の体積比で含む混合気体と触媒を入れて密封し, 温度一定に保って反応させた。その際, 反応(3)は全く進行せずメタンは生成しなかった。反応開始からメタノールが完全に分解して反応(2)が平衡に達するまでの, 水素と一酸化炭素の濃度を測定した。
次に, 容積が自由に変化する反応容器に, メタノール 2.00molと水蒸気 3.00molおよび触媒を入れて密封し, 一定温度, 一定圧力のもとで反応させた。反応前の混合気体の体積はV0であり, この条件でも反応(3)は全く進行しなかった。
②反応開始から十分に時間が経過したとき, メタノールは反応(1)により完全に分解し, 反応(2)は平衡状態に達した。このとき, 混合気体の体積はV1となり, 反応容器中の水素の物質量は 5.76molであった。
通常の化学反応を密閉した容器内で行った場合, 反応前後において分子を構成する各原子の総数は変化しない。このことから, メタノールが完全に分解したとき, 各原子に着目すれば, 以下の関係式が成立する。
ただし, 反応前の混合気体中のメタノールの濃度を[CH3OH]0, 水蒸気の濃度を[H2O]0で表し, 反応後の水素, 一酸化炭素, 二酸化炭素, 水蒸気の濃度を, それぞれ[H2], [CO], [CO2], [H2O]で表す。また, 反応前および反応後における混合気体の体積を, それぞれV0, V1で表す。
V0×[CH3OH]0 = V1×([CO] + [CO2]) …(6)
V0×(4[CH3OH]0 + 2[H2O]0) = V1×( I ) …(7)
V0×([CH3OH]0 + [H2O]0) = V1×( II ) …(8)
なお, 関係式(6)~(8)は( エ )。
問1. ( ア )~( ウ )にあてはまる適切な語句を答なさい。
答
問2. 下線部①について, 次の(i), (ii)の場合における水素と一酸化炭素の濃度変化として最も適切なものを, 図1の(あ)~(か)から選びなさい。ただし, 横軸の反応時間に対して縦軸の水素と一酸化炭素のモル濃度のスケールは, すべての図で同じである。
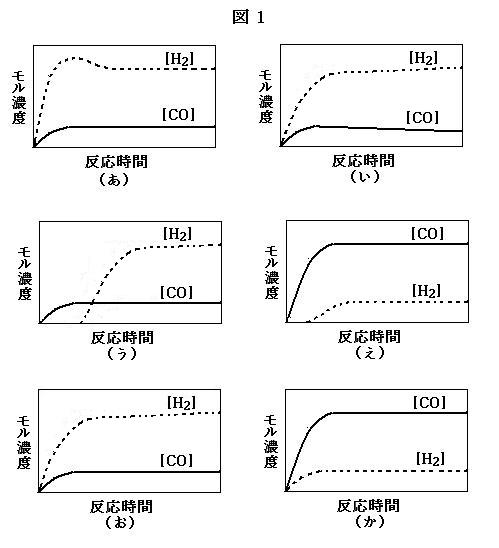 (image417)
(image417)(i) 反応(2)の反応速度定数が小さいために, 反応(1)がある程度進行しないと反応(2)が進行しない場合。
(ii) 反応(2)の反応速度定数が非常に大きい場合。
答
問3. 下線部②の状態に関して, 以下の問いに答えなさい。
(1) V1はV0の何倍となりますか。有効数字2桁で答えなさい。
答
(2) 反応後の一酸化炭素の物質量[mol]を, 有効数字2桁で答えなさい。
答
(3) 反応(2)の平衡定数K2を, 有効数字2桁で答えなさい。
答
(4) ( I ), ( II )にあてはまる適切な式を, [H2], [CO], [CO2], [H2O]を用いて答えなさい。
答
(5) ( エ )にあてはまる適切な文を, 次の(あ)~(え)から選びなさい。
答
(あ) 反応前後で温度が変化する場合は成立しない。
(い) 反応前後で圧力が変化する場合は成立しない。
(う) 反応前後で温度と圧力がともに変化する場合も成立する。
(え) 反応前後で温度と圧力がともに変化する場合を除いて成立する。