問1の答
(ア. 同位) (イ. アルミニウム) (ウ. ジ) (エ. 銑) (オ. 溶融) (カ. 同素)
(キ. 低) (ク. 高) (ケ. 酸化)
クラーク数…地球皮部の元素百分率を表したもの。地球皮部は地球全質量の約0.7%を構成するとする。その地球皮部の大気, 海水, 岩石の含質量をそれぞれ0.03%, 6.91%, 93.06%として, 皮部を構成する元素の百分率を算出したもの。1~15番の元素百分率は次のとおりである。
O(49.5%) Si(25.8%) Al(7.56%) Fe(4.70%) Ca(3.39%) Na(2.63%) K(2.40%) Mg(1.93%) H(0.87%) Ti(0.46%) Cl(0.19%) Mn(0.09%) P(0.08%) C(0.08%) S(0.06%)
金属の同素体(単体の変態)
●単体の金属結晶は, 主として次の三つの構造がある。
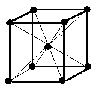
(1)体心立方格子 image1・・・配位数:8, 格子内原子数:2, 格子内原子体積占有率:68%, 例 Na, K, Ba, Cr, Ra, V, Nb, Ta, W, etc. (配位数:注目原子を取り巻く最も近い他の原子の数を意味する)
(2)面心立方格子 image2・・・配位数:12, 格子内原子数:4, 格子内原子体積占有率:74%, 例 Ca, Al, Pd, Pt, Cu, Ag, Au, Pb, etc.
(3)六方最密構造 image6・・・配位数:12, 格子内原子数:6, 格子内原子体積占有率:74%, 例 Be, Mg, Hf, Ru, Os, Zn, Cd, etc.
体心立方格子
 面心立方格子
面心立方格子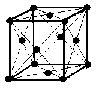
原子数…(1/8)×8 + 1 = 2 原子数…(1/8)×8 + (1/2)×6 = 4
六方最密構造
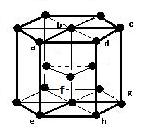
原子数…(1/6)×12 + (1/2)×2 + 3 = 6
abcdefghは:原子数…(1/8)×8 + 1 = 2
問2の答 1:2
●ジテツ鉱主成分のFe3O4は, 酸化鉄(II):FeO と 酸化鉄(III):Fe2O3の複合したものと考えられる。それを合体すると, その組成式はFe3O4
●ジテツ鉱主成分の組成式:Fe3O4に存在するFe2+とFe3+の物質量[mol]をm, nとすると, 次式が成立する。
鉄元素において
m + n = 3 …①
酸素元素において
m + (3/2)n = 4 …②
①と②から m=1, n=2
問3の答
Fe2O3 + 3CO → 2Fe + 3CO2
Fe3O4 + 4CO → 3Fe + 4CO2
問4の答 27個
質量数≡陽子数(原子番号)+中性子数
問5の答
[常磁性物質]…物質を外部磁場中へ入れると, 物質が外部磁場方向に磁化される。しかし, 外部磁場から出すと, いいかえるならば, 外部磁場をゼロにすると, 巨視的な範囲では全く磁化を示さない。
この原因は, 外部磁場中では, 物質粒子の固有磁気モーメントが外部磁場によってその向きをある程度そろえるが, 外部磁場がゼロならば, 固有磁気モーメントの向きが統計的に乱雑で全体としての合成はゼロになることによる。
物質粒子の固有磁気モーメントは次のことが考慮される。(1)電子のスピンによるもの, (2)分子, 原子またはイオン内電子の軌道運動の角運動量によるもの, (3)原子核によるもの。
一般に, (3)は(1),(2)に比べて小さく, 普通の意味での常磁性では無視される。閉殻電子だけをもつ原子またはイオンは(1),(2)がゼロで常磁性を示さない。
[強磁性物質]…物質を外部磁場中へ入れると, 物質が外部磁場方向に強く磁化される。また, 外部磁場を取り去っても残留磁化を残し, 磁気ヒステリシス(磁化の強さは外部磁場の強さだけでは一義的に定まらず, 以前の磁化状態に関係すること)を示す。強磁性物質は自発磁化(電子のスピンによる磁気モーメントに起因し, ある程度このモーメントが平行で安定になっており, 外部磁場がなくても磁気をもつ状態)を保持している。
問6の答 ステンレス鋼
炭素鋼(鉄元素+炭素含有量約0.5%以下のもの軟鋼, 以上のもの硬鋼)に1種または2種以上の合金元素を添加して所望の性質を与えた合金。
ステンレス鋼…炭素鋼に主にクロムを多く含み, 極めて耐食性にすぐれ耐熱鋼としても重要である。(例)16-2ステンレス鋼 … 炭素:<0.20%, クロム:約16%, ニッケル:約2.0%
問7の答
鉄(II)化合物…(硫酸塩) 硫酸鉄(II) FeSO4
(シアノ錯塩) ヘキサシアノ鉄(II)酸カリウム K4[Fe(CN)6]
鉄(III)化合物…(硫酸塩) 硫酸鉄(III) Fe2(SO4)3
(シアノ錯塩) ヘキサシアノ鉄(III)酸カリウム K3[Fe(CN)6]
問8の答
●鉄は塩酸を加えると次のように反応しFeCl2を生成して溶ける:
Fe(s) + 2HClaq → FeCl2aq + H2(g)
●鉄は濃硝酸を加えると硝酸の酸化作用によって次のようにはじめに反応して鉄表面にち密な黒サビのFe3O4の不動態皮膜を形成し内部を保護する。
3Fe(s) + 8HNO3aq → Fe3O4(s) + 8NO2(g) + 4H2O(l)
問9の答
触媒:化学反応で, 比較的少量存在し, それ自身は反応前後で変化しないが, 活性化エネルギー値を変えて反応の速度を変える。
正触媒…活性化エネルギー値を低くして反応速度を早くする。
負触媒…活性化エネルギー値を高くして反応速度を遅くする。
問10
(1)の答 0.13 ㍑
硫化鉄(II)に塩酸を加えて反応させると
FeS + 2HCl → FeCl2 + H2S
上式から, 腐卵臭気体H2Sの物質量はFeSと同値である。また, 標準状態の理想気体は1 molで22.4 L(㍑)である。そこで, H2Sの標準状態の体積Vは, FeSの式量は56 + 32 = 88, そこで, モル質量[g]は88 gから
V = 22.4×(0.50/88) = 0.127 L
(2)の答 酸化剤 0.18 [g]
二酸化硫黄は硫化水素と反応すると
SO2 + 2H2S → 3S + 2H2O
二酸化硫黄SO2の中のS原子の酸化数は減少:SO2 → Sにおいて, +4 → 0
よって, 二酸化硫黄SO2は酸化剤として作用している。
また, 上式から1 molの二酸化硫黄SO2は, 2 molのH2Sが反応している。また, SO2の分子量は64,
よって
64×(0.50/88)×(1/2) = 0.182 [g]