[問題] 次文において下の各問いに答えなさい。気体は全て理想気体して挙動するとする。また, 答の数値は有効数字3桁とする。
可逆反応の化学平衡状態にある混合物質は, 温度, 圧力, 濃度などを変化させると, その状態を(ア)方向に平衡は移動して新しい化学平衡状態になる。これを(イ)の原理という。この原理は理論的には熱力学のギブスの自由エネルギーに結び付けられる。
例として, 二酸化窒素と四酸化二窒素の混合気体の化学平衡状態を考えてみる。 その平衡状態は反応式で表すと次のようになる(image149)。
2NO2(気) ⇄ N2O4(気) …①
いま, 平衡状態の①において, 一定温度で圧力を増加させると, 平衡は, 気体分子の数を(ウ)てその圧力増加を(エ)させる方向, 言いかえると, (オ)辺から(カ)辺の方向に移動して, 二酸化窒素が(エ)し四酸化二窒素が(キ)した後に新しい平衡状態になる。この平衡状態の移動において, 気体の色の変化を観察すると, 赤褐色が徐々にうすくなり無色に近づく。平衡状態にある二酸化窒素と四酸化二窒素のモル濃度を[NO2]と[N2O4]で表すと①式の平衡定数Kは次式のようになる。
K = (ク)
また, 温度変化から可逆反応の平衡状態の移動を考えるには, 化学変化にともなう(ケ)熱Qの出入り, いわゆる.発熱か.吸熱をみればよい。次の式は二酸化窒素が四酸化二窒素に変化するときの熱化学方程式である。
2NO2(気) = N2O4(気) + Q kJ …②
二酸化窒素と四酸化二窒素の混合気体の平衡状態において, 圧力一定で温度を変化させると, 平衡移動の方向は熱化学方程式②の(ケ)熱Qの正負を考慮することによって決まる。
問1.上文の(ア)~(ケ)に下の[語句・式]から最も適合したものを1つ選択して書き入れなさい。
[語句・式] 減少, 右, 反応, 増やし, 打ち出す, 左, 増加, [NO2]2/[N2O4], ルシャトリエ, 減らし,
[N2O4]/[NO2]2, 打ち消す, アボガドロ, 変化
答
問2.上文の下線部分において, 色変化の原因を説明しなさい。 答
問3. 熱化学方程式②の反応熱Qの値を求めなさい。ただし, NO2(気)とN2O4(気)の生成熱は-33.2 kJ, -9.20 kJ とする。 答
問4. 平衡状態①において, 平衡移動は, 圧力を一定に保ったまま温度を上昇させると, 「変化なし」, 「左辺から右辺へ」, 「右辺から左辺へ」のどれですか。 答
問5. 圧力変化と平衡移動の関係を検討するために次の実験をした。
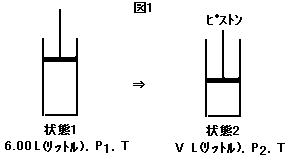
[実験I] 図1(image150)のように, 窒素ガスをシリンダー内に温度T, 圧力P1の状態で 6 L(リットル)入れ, 温度を一定に保持して徐々にピストンで圧縮を行った。このとき体積は圧力P2でV L(リットル)になった。
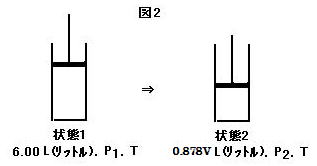
[実験2] 図2(image151)のように, 平衡状態の二酸化窒素と四酸化二窒素の混合ガスをシリンダー内に温度T, 圧力P1の状態で 6 L(リットル)入れ, 温度を一定に保持して徐々に圧縮を行った。このとき体積は圧力P2で0.878V L(リットル)になった。液化は見られなかった。状態1の平衡定数Kは25.0 (mol/L)-1, 二酸化窒素のモル濃度は5.00×10-2 mol/Lであった。
(1) [実験1]と[実験2]の状態1でのN2, NO2, N2O4の物質量は何mol ですか。 答
(2) [実験2]状態2の混合気体の全物質量は何 mol ですか。 答
(3) [実験2]において, 状態2でのシリンダー内に含まれるNO2とN2O4の各物質量は何mol ですか。また, この状態2のNO2とN2O4の物質量を使って平衡定数の値を求めなさい。
答