問1の答1
プロパン…2220 kJ/mol, メタン…892 kJ/mol
燃焼前のプロパンとメタンの物質量mol は 1.12/22.4 = 0.05 mol (0℃, 1.01×105Paの気体は理想気体で種類に関係なく全て22.4 L) このプロパンとメタンを25℃で完全燃焼させると, プロパンでは111 kJ, メタンでは44.6 kJ の熱が発生, 1 mol当り(この発生熱量を燃焼熱という)では次のようになる。
プロパン…111/0.05 = 2220 kJ/mol, メタン…44.6/0.05 = 892 kJ/mol
問2の答2
プロパン…50.5 kJ メタン…55.8 kJ
1g のプロパンの物質量mol は…1/分子量 = 1/44 mol よって問1の燃焼熱2220 kJ/molから
2220×(1/44) = 50.5 kJ
1g のメタンの物質量mol は…1/16 mol よって問1の燃焼熱892 kJ/mol から
892×(1/16) = 55.8 kJ
問3の答3
メタンの方が二酸化炭素の発生量が少ない。
プロパンとメタンの燃焼熱の熱化学方程式は, 問1から次のようになる。
プロパンでは…C3H8(気体) + 5O2(気体) = 3CO2(気体) + 4H2O(液体) + 2220 kJ
メタンでは…CH4(気体) + 2O2(気体) = CO2(気体) + 2H2O(液体) + 892 kJ
いま, かりにプロパンとメタンから892kJの熱量を取り出すとすると, それぞれの発生する二酸化炭素の物質量molは, 上述の熱化学方程式から
プロパンでは…3×(892/2220) = 1.21mol
メタンでは…1×(892/892) = 1mol
よって, メタンの方が二酸化炭素の発生量が少ない。
問4の答4 106 kJ/mol
プロパンの生成熱をQとすると, その熱化学方程式は次のようになる。
3C(黒鉛) + 4H2(気体) = C3H8(気体) + Q kJ …①
また, 問1と4の熱化学方程式は
C3H8(気体) + 5O2(気体) = 3CO2(気体) + 4H2O(液体) + 2220 kJ …②
C(黒鉛) + O2(気体) = CO2(気体) + 394 kJ …③
H2(気体) + (1/2)O2(気体) = H2O(液体) + 286 kJ …④
熱化学方程式では, 各化合物の化学式はエネルギー値を意味しているので, ①から, プロパンの生成熱Qは次式のようになる。
Q = (3C + 4H2) - C3H8 …①'
また,
②から, C3H8 = (3CO2 + 4H2O + 2220) - 5O2 …②'
③から, 3C = 3(CO2 + 394) - 3O2 …③'
④から, 4H2 = 4(H2O + 286) - 2O2 …④'
よって,
②'~④'を①'に代入すると
Q = 394×3 + 286×4 - 2220 = 106 kJ/mol
①~④を参照してエネルギーレベルで図示すると次のようになる(image136)。
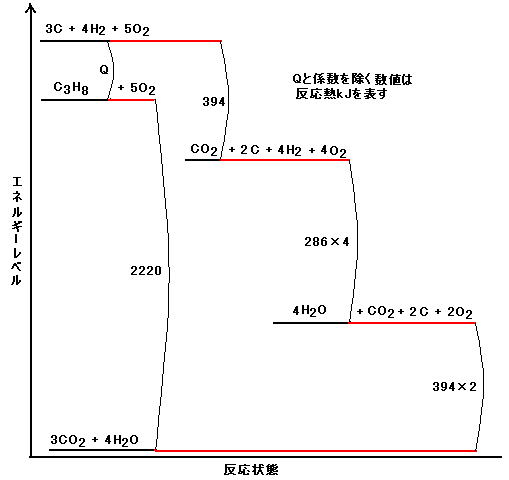
よって, Q + 2220 = 394 + 286×4 + 394×2
∴Q = 106 kJ/mol