問1
i の答 Diagram II (原点を通る直線)
● 気体は形もなく固定した体積も持たない。気体が入り込むどんな空間でも全体に均一に広がり満たされる。違った気体が加熱されたり圧縮されたりすると, それらの気体は実際上存在する気体のそれぞれに関係なく, 全てほぼ同じように挙動をする。
● ボイルの法則は 1662年 ロバート ボイルによって実験的に実証されまとめ上げられた。その法則は次のようになる : 一定温度で一定質量の気体の体積はその圧力に逆比例する。別の言葉では, もし気体試料の圧力が 2倍になると, その体積は半分になる。
ボイルの法則は圧力 P に対しての体積 V ではグラフにおいて下図 I 中に示され, V = kT/P としての式で書くことができる。 ここで kT は一定絶対温度 T での気体の一定質量に対する定数である。V と 1/P との間の関係は図 II 中に示されるように直線である。
 (image548)
(image548)Q1
Answer of i Diagram II (A straight line through the origin)
● Gases have neither shape nor fixed volume. They spread out to fill uniformly the whole of any space they enter. When different gases are heated or compressed, they all behave in approximately the same manner, irrespective of the gas that is actually present.
● Boyle's law was summed up the experimental evidence in 1662 by Robert Boyle. The law is as follows : The volume of a fixed mass of gas is inversely proportional to its pressure at constant temperature. In other words, if the pressure of a sample of gas is doubled, its volume is halved.
Boyle's law may be graphically expressed in Diagram I above for Volume V against pressure p, and can be written in symbols as V = kT/P where kT is a constant for a fixed mass of gas at constant absolute temperature T. The relationship between V and 1/P is linear, as shown in Diagram II.

ii の答
(1) 気体の圧力が高くなるとき, 粒子間の力が顕著になって理想気体の圧力からずれてくる : 粒子間の衝突は完全弾性ではない。
(2) 気体の温度が低くなるとき, 粒子間の力が顕著になって理想気体の体積からずれてくる : 粒子は一定の体積を持つ。
(1) 実在気体の圧力を考慮すると,
● 高い圧力では, 分子間の引力が顕著になる ; それは実在気体の体積が理想気体のものより小さいくなる。
● 非常に高い圧力では, 分子間の反発力が顕著になる ; それは実在気体の体積が理想気体のものより大きくなる。
(2) 実在気体の温度の場合においては,
● 低い温度では, 分子間力がより顕著になる。
● 臨界温度においてその温度以上では気体は圧力採用だけで液化させることはできない。
いま, (1)と(2)を通して便宜のために, 気体中の粒子は分子として記述される。
Answer of ii
(1) When a pressure of gas is considerably high, the forces between particles become significant to deviate from the pressure of ideal gas : the collisions between particles are not perfectly elastic.
(2) When a temperature of gas is low, the forces between particles become significant to deviate from the volume of ideal gas : particles have a certain volume.
(1) On considering pressures of a real gas,
● At high pressure, attractive forces between molecules become significant ; the volume of a real gas is less than that of an ideal gas.
● At very high pressure, repulsive forces between molecules become significant ; the volume of a real gas is greater than that of an ideal gas.
(2) In a case of temperatures of a real gas,
● At low temperatures, intermolecular forces become more significant.
● The critical temperature is the temperature above which a gas cannot be liquefied by the application of pressure alone.
Now, for the sake of convenience throughout (1) and (2), the particles in gas are described as molecules.
問2
i の答
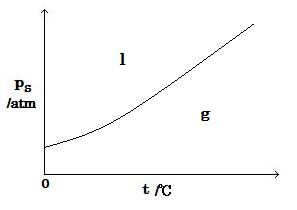 (image550)
(image550)l : 液相 g : 気相
(わずかにくぼんだ上昇曲線で, すなわちほぼ放物線で, 原点から始まらない。)
●1 '相'は, 化学的組成と物理的状態において, 全く均一にある物質状態として定義される。純粋物質に対しては, '相' と '状態' の語句は本質的に同じ意味を持つ。
2つの混合物が考えられるとき, '状態' の語句を使用することは不適切である。共に混ざる 2つの液体は, 単一な液体状態ではなく単一な液体相を形成する。
●2 温度, 圧力, 体積, および濃度の条件はその下で異なった相が安定であり, ひとつの状態図で示すことができる。状態図では相が温度と圧力の特定条件で最も安定であることを記述する。
●3 '平衡' はバランスを示すのに使用される語句である。主として平衡の2つのタイプは静的平衡と動的平衡である。静的平衡はバランスの状態を維持するのに動きを必要としない。一方, 動的平衡は反対方向に活発に動く2つの目的物間でのバランスによって成し遂げられる。
●4 物理的過程での動的平衡
○ 液体が加熱されるとき, 試料の全エネルギーが増加する。このエネルギーはほとんど動的エネルギーの形成をとり粒子が場所から場所へ移動するようになる。ランダムな衝突が各粒子のエネルギーを絶えず変化させることを引き起こす。
○ 結果として, 表面のいくつかの粒子は十分なエネルギーを得て液体内の粒子を保持する力に打ち勝つようになる。液体表面でのいくつかの粒子は液体上の空間へ入り気体になる。この状態の変化は蒸発と呼ばれている。蒸発は沸点以下のどんな温度でも液体表面で生じる。
○ 例として, 液体臭素の蒸気はひとつの温度で形成されその理由は最もエネルギー豊富な臭素分子が液体表面から飛び出ることによる。
また, 蒸気中の最小のエネルギーでの分子は液体状態へもどる : この過程は凝縮と呼ばれている。蒸発と凝縮は両方とも容器の中で同時に起っている。容器中の気体の圧力は一定温度での飽和蒸気圧になる。
蒸気の濃度が変わらないとき, 凝縮の速度は蒸発の速度に等しい。この平衡過程は簡単な式によって表せられる :
Br2(l) ⇄ Br2(g)
ここで Br2(l) → Br2(g) は正反応で, Br2(g) → Br2(l) は逆反応である。
●5 化学反応と化学平衡
反応物と生成物の平衡でのバランスは平衡混合または平衡組成と呼ばれている。全ての化学反応は平衡混合を形成する傾向を示す。化学平衡は反応物と生成物の濃度いわゆるモル濃度が一定に残るときに生じる。
可逆反応は平衡混合において反応物の顕著な量を含む場合を記述する。
Q2
Answer of i

l : liquid phase g : gas phase
(Slightly concave rising curve, that is, almost a parabola, not starting from the origin.)
●1 A 'phase' is defined as a state of matter that is uniform throughout, in chemical composition and in physical state. For a pure substance, the words 'phase' and 'state' have essentially the same meaning.
When a mixture of two substances is considered, it is inappropriate to use the word ' state'. Two liquids that mix together form a single liquid phase, not a single liquid state.
●2 The conditions of temperature, pressure, volume, and concentration under which different phases are stable can be shown on a phase diagram. A phase diagram describes which phase is most stable under particular conditions of temperature and pressure.
●3 'Equilibrium' is a term used to denote balance. The two main types of equilibrium are static equilibrium and dynamic equilibrium. Static equilibrium does not have to move to maintain the state of balance. On the other hand, dynamic equilibrium is established by a balance between two objects actively moving in opposite directions.
●4 Dynamic equilibrium for a physical process.
○ As a liquid is heated, the total energy of the sample increases. This energy mostly takes the form of kinetic energy as the particles move from place to place. Random collisions cause the energy of each particle to change continually.
○ As a result, some particles at the surface gain sufficient energy to overcome the forces holding them within the liquid. Some of the particles at the liquid surface enter the space above the liquid and become a gas. This change of state is called evaporation. Evaporation occurs at the surface of a liquid at any temperature, below the boiling point.
○ For example, vapour of liquid bromine is formed at a temperature because the most energetic bromine molecules escape from the surface of the liquid : this process is called vaporization or evaporation.
Also, the least energetic molecules in the vapour return to the liquid state : this process is called condensation. Vaporization and condensation are both happening simultaneously in a vessel. A pressure of gas in vessel becomes the saturated vapour pressure at a fixed temperature.
When the concentration of the vapour remains steady, the rate of condensation equals the rate of vaporization. This equilibrium process may be represented by a simple equation :
Br2(l) ⇄ Br2(g),
where Br2(l) → Br2(g) is the forward change, and Br2(g) → Br2(l) is the backward change.
●5 Chemical reactions and chemical equilibrium.
A balance of reactants and products at equilibrium is called the equilibrium mixture or equilibrium composition. All chemical reactions show a tendency to form an equilibrium mixture. Chemical equilibrium occurs when the concentrations (i.e. molar concentration) of reactants and products remain constant.
A reversible reaction describes the case where the equilibrium mixture contains significant amounts of the reactants.
ii の答
沸騰温度では, 蒸発が液体表面と液体内の中で起きて, そして蒸気の泡が液体内で形成され, ここでは飽和蒸気圧は外気の圧力に等しい。もし外気の圧力を大きくすると, 液体は沸騰しなくなる。そこで, 沸騰液体はより高温で加熱してその蒸気圧を大きくする必要がある。それゆえ, 液体の沸騰温度は外圧に依存する。
●1 蒸発は液体表面中の粒子がその粒子間引力より大きいエネルギーを持つとき起きる。
●2 沸騰は蒸気の泡が表面でなく液体内で生じるとき起きる。純物質は 1 atm の圧力で沸騰点 (Tb) と呼ばれる温度で沸騰する。沸騰の間で供給されるエネルギーは液体状態中の粒子間力に打ち勝つために必要とされる。
●3 液体表面は外圧を持つ気体で覆われているので, 液体粒子のいくつかは表面での気体粒子の衝突によって容易には液体上に入り込むことはできない。
液体が沸点で加熱されるとき, そのエネルギーは運動エネルギーの形成に取られ, 液体中の粒子は液体内の粒子を保持する力に打ち勝つのに十分なエネルギーを得る。
結果として, 蒸発が液体表面と液体内の中で起きて, そして蒸気の泡が液体内で形成され, ここでは飽和蒸気圧は外気の圧力に等しい。もし外気の圧力を大きくすると, 液体をより高温で加熱してその蒸気圧を大きくする必要がある。それゆえ, 液体の沸騰温度は外圧に依存する。
Answer of ii
At the boiling temperature, the vaporization occurs at the surface of liquid and the body within liquid, where the saturated vapor pressure is equal to the pressure of the external gas.
If the pressure of the external gas becomes larger, the liquid stops boiling. So the boiling liquid needs to add heat at higher temperature to raise the vapor pressure. As a result, the boiling temperature of a liquid depends on the external pressure.
●1 Evaporation occurs when particles in the liquid surface have energy greater than the forces of attraction between the particles.
●2 Boiling occurs when bubbles of vapor form within the body of the liquid (not just at the surface). A pure liquid boils at the temperature which is called the boiling point (Tb) at 1 atm of pressure. Energy supplied during boiling is needed to overcome the forces between the particles in liquid state.
●3 As a surface of a liquid is covered with gas to have an external pressure, some of liquid particles cannot enter the space above the liquid easily by collisions of gas particles at the surface.
When a liquid is heated at boiling temperature, the energy mostly takes the form of kinetic energy, and the particles in the liquid gain sufficient energy to overcome the forces holding them within the liquid.
As a result, the vaporization occurs at the surface of liquid and the body within liquid, and bubbles of vapor are formed within the body of the liquid, where the saturated vapor pressure is equal to the pressure of the external gas. If the pressure of the external gas becomes larger, the liquid is needed to add heat at higher temperature to raise the vapor pressure, therefore, the boiling temperature of a liquid depends on the external pressure.
iii の答
混合された液体上の飽和蒸気の組成は液体中の分子間力に依存する。外圧が一定温度で減圧されるとき, 液体中の分子間のその力が弱ければ弱いほどその分子は飽和蒸気中で分解してより多く存在する。
純粋液体は外圧 1 atm でそれぞれ異なった沸点をもつ。そこで, たとえば, メタノール (b.p 64.5℃) と水 (b.p. 100℃) のような 2つの液体が一定の外圧と温度で固定の濃度で混ざっているとする。
最初に, その外圧が一定温度で減らされると, 混合液体の上の飽和蒸気圧は液体中のメタノールと水の間のより弱い分子間力のためにより多くのメタノールを含む。
次に, その飽和蒸気圧を冷却することによって得られた液体において, 外圧が再び一定温度で減少させる。形成された飽和蒸気圧は最初のものよりもより多くのメタノールを含む。
上の同じ様な方法で, 数回の分留がさらに減圧下でくり返されると, 飽和蒸気はほぼメタノールだけになる。
Answer of iii
A composition of the saturated vapour above liquid mixed depends on the intermolecular force in the liquid. When the external pressure decreases at a constant temperature, weaker the force between molecules in the liquid, larger the molecules exist to decompose in the saturated vapor.
Pure liquids have different boiling points at 1 atm of external gas, respectively. So, for example, consider two liquids such as methanol (b.p. 64.5℃) and water (b.p. 100℃) mix with a fixed concentration at a constant external pressure and temperature.
First, when the external pressure decreases at a constant temperature, the saturated vapour above the liquid mixed includes a larger amount of methanol because of the weaker intermolecular forces between methanol and water in the liquid.
Next, on the liquid gained by cooling the saturated vapour, the external pressure decreases at a constant temperature again. Then the saturated vapour formed contains a larger amount of methanol than the first step.
In the same way like that above, when the several distillations are furthermore repeated under reduced pressure, the saturated vapour becomes almost methanol alone.
問3の答 120 (g/mol) (有効数字3桁)
揮発性有機液体のモル質量を M (g/mol) とすると, 理想気体の状態方程式は次のように表わされる :
PV = (W/M)RT …(i)
ここで, P (Pa) は圧力, V (cm3) は体積, W (g) は質量, R (Pa m3 mol-1K-1) は気体定数, および T (K) は絶対温度である。
(i)式を (ii) の形に書き換える :
M = WRT/PV …(ii)
いま, 次の値
W = 0.597 (g)
R = 8.31 (Pa m3 mol-1K-1)
T = 273 + 100 = 373 (K)
P = 1.01×105 (Pa)
V = 153 [cm3] = 153×10-6 (m3)
を (ii)式に代入してモル質量を計算すると,
M = {0.597 (g)}{8.31 (Pa m3 mol-1K-1)}{373 (K)}/{1.01×105 (Pa)}{153×10-6 (m3)}
= 120 (g/mol) (有効数字3桁)
Answer of Q3 120 (g/mol) (3 sig. figs.)
Consider the molar mass of a volatile organic liquid, M (g/mol), and so the ideal gas equation is shown as follows :
PV = (W/M)RT …(i),
where P (Pa) is the pressure, V (cm3) the volume, W (g) the mass, R (Pa m3 mol-1K-1) the gas constant, and T (K) the absolute temperature.
Write the equation (i) in the form (ii) :
M = WRT/PV …(ii)
Now, substitute the following values :
W = 0.597 (g)
R = 8.31 (Pa m3 mol-1K-1)
T = 273 + 100 = 373 (K)
P = 1.01×105 (Pa)
and
V = 153 [cm3] = 153×10-6 (m3)
for the equation (ii) and calculate the molar mass :
M = {0.597 (g)}{8.31 (Pa m3 mol-1K-1)}{373 (K)}/{1.01×105 (Pa)}{153×10-6 (m3)}
= 120 (g/mol) (3 sig. figs.)