Japanese-English Exam Similar Question 5-1
下の問題, 問Iと問II に答えなさい。
問I ケイ素の電離電子の数に対して, 第1番目から7番目まで続けてのモルイオン化エネルギーの対数プロット図が, 下(image596)に示されている。
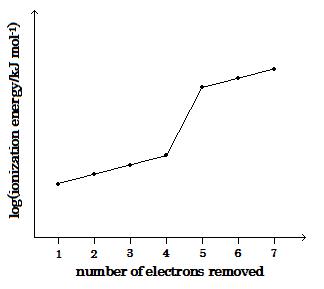 (image596)
(image596)i 元素のモル第1イオン化エネルギーの語句を定義しなさい。
答
Answer the questions below, QI and QII.
QI A sketch of the plot of the logarithms of the first seven successive molar ionization energies of silicon against the number of electrons removed is shown below (image596).
 (image596)
(image596)i Define the term molar first ionization energy of an element.
Answer
ii エネルギー変化がケイ素のモル第2イオン化エネルギーに等しくなるプロセスを表わす式を書きなさい。
答
ii Write an equation to represent the process whose energy change is equal to the molar second ionization energy of silicon.
Answer
iii 第1, 第2, 第3, そして第4の電子が電離されるにつれてモルイオン化エネルギー値が徐々に増加することを説明しなさい。
答
iii Explain the gradual increase in the molar ionization energy values as the first, second, third, and fourth electrons are removed.
Answer
iv モル第5イオン化エネルギーが第4よりも非常に大きいのは何故かを説明しなさい。
答
iv Explain why the molar fifth ionization energy is very much greater than the fourth.
Answer
問II 化合物の二酸化ケイ素 SiO2 と四塩化ケイ素 SiCl4 の二つとも共有結合を含んでいるがそれらの融点は各々 1650 ℃と -70 ℃であり, 非常に違っている。
i 下の化合物の各々に存在する構造型の名称を与えなさい。
SiO2 SiCl4
答
QII The compounds silicon dioxide, SiO2, and silicon tetrachloride, SiCl4, both contain covalent bonding but their melting points are very different, being 1610 ℃ and -70 ℃ respectively.
i Give the name of the type of structure present in each of the compounds.
SiO2 SiCl4
Answer
ii その2つの化合物の融点はそれらの構造にどのように関係しているかを説明しなさい。
答
ii Explain how the melting points of the two compounds are related to their structures.
Answer