原子の電気陰性度は共有された電子対を引き付ける能力の基準を示す。
共有結合が同じでないふたつの原子間に存在する場合, ふたつの内のひとつが電子対のより多くの分割をもつ。異なった分割が生じるのは異なる原子が電子対に対して違った引力を持つからである。原子の電気陰性度は共有された電子対を引き付ける能力のラフな尺度である。
電気陰性度は相対的な量でありポーリング基準で, セシウムの0.8からフッ素の4.0の範囲にある。より大きな電気陰性度の原子は電子の共有結合のより大きな分担をもつ。そこで電子密度はより大きな電気陰性度の原子の方へ (いわゆるより接近して) 歪められる。ヒ素化ガリウム GaAs の例において, 極大電子密度はガリウム (電位陰性度 1.8) よりもヒ素 (電気陰性度 2.2) の方へより接近して生じる。
Answer of Q1
The electronegativity of an atom is a measure of its ability to attract a shared electron pair.
Where a covalent bond exists between two atoms that are not identical, one of the two will have a greater share of the electron pair. Unequal sharing happens because different atoms have different powers of attraction for electron pairs. The electronegativity of an atom gives a rough measure of its ability to attract a shared electron pair.
Electronegativity is a relative quantity and is measured on the Pauling scale, ranging from 0.8 for caesium to 4.0 for fluorine. The atom with the greater electronegativity will have a larger share of the bonding pair of electrons. So the electron density will be skewed towards (i.e. higher near) the more electronegative atom. In the example for gallium arsenide GaAs, the maximum electron density occurs closer to arsenic (electronegativity 2.2) than to gallium (electronegativity 1.8).
問2
(i)の答
分散力は双極子や非双極子の分子両方において沸点を考慮するときに顕著になる。この力は第16族の水素化物のH2SからH2Teまでの分子に対して電子の増加と瞬間的双極子の増加でより強くなる。
このことはその分子間の引力を増加させ, それ故 H2S から H2Te までの水素化物の沸点を増加させる。
水素結合はこれらの化合物には存在しない。その理由は硫黄, セレンおよびテルルの元素は十分な高い電気陰性度を持っていないことによる。
● 液体が沸騰するとき, エネルギーは液体状態中の全ての分子間引力に打ち勝つ必要がある。
● 分散力は原子や分子の間に作用する引力である。それらは弱く, せいぜい共有結合強度の5%である。分散力は原子や分子内の電子密度の一時的不均一分布から生じる。
平均で, 非極性分子 (あるいは各原子) 中の電子密度は均一に分布している。しかし, 瞬時では, その分布は均一ではなく瞬間的双極子が生じる。瞬間的双極子はそのとき隣接する分子中の電子を自身で配列しその力は引力となる。
この種の瞬間的双極子はまた誘導双極子と呼ばれている。双極子はゆれて生滅し, 近辺の他の分子中に双極子を誘導する。全てこれらの双極子は隣接分子中の電子を引き付けたり反発したりして分子間に引力を維持するように順応する。ひとつの分子と他の分子との瞬間的双極子間の力は分散力と呼ばれている。
● 分散力は関連している分子の極性増加で増大する。極性は電子密度が外部電場に従うときどのぐらい容易に歪められるかを計測する。それは多くの因子に依存している; 例として極性は一般に分子の表面積と存在する電子数で増加する。
● 18族の元素において, 分散力は原子間に作用する引力のみである。結果として, 融点と沸点はこれらの力の弱さを反映して非常に低い。融点と沸点の値は原子番号増加で大きくなる。原子番号は存在する電子数を示し, それゆえ関与する原子の極性のおよその物差しである。
● ハロゲン元素(17族)は二原子分子で, 一般に X2 として示される。原子番号増加で融点と沸点増加のはっきりした傾向がありそれゆえ電子数を増加させる。ハロゲンの融点と沸点は希ガス(18族)のそれらより全体にわたって高い。
この差の理由はハロゲン分子が二原子から成りそれらの間には共有結合が存在しているからである。ハロゲン分子中の電子密度は希ガスのものよりもより拡がっておりそれゆえハロゲン分子はより極性である。
● 水の中に存在する最も顕著な分子間力は水素結合である。水素結合の効果は水において他の16族の水素化物 (H2S, H2Se, および H2Te) よりも顕著に高い沸点をもつことになる。
後続の3つの物質 (H2S, H2Se, および H2Te) での沸点の確実な上昇傾向は存在する電子数が増加するにつれて分散力が増加することによる。水素結合はこれらの化合物には存在しない。その理由は硫黄, セレンおよびテルルの元素は十分な高い電気陰性度を持っていないことによる。
Q2
Answer of (i)
Dispersion forces are significant when considering the boiling points of both polar and non-polar molecules.
These forces become stronger with increasing in electrons for the molecules from H2S to H2Te of hydrides in the Group 16 and with increasing the instantaneous dipole for them.
This results in increasing attraction between the molecules and hence increasing boiling points for the hydrides from H2S to H2Te.
Hydrogen bonds are not present in these compounds because the elements sulfur, selenium, and tellurium do not have sufficiently high electronegatively values.
● When a liquid boils, energy is required to overcome all the forces of attraction between the molecules in the liquid state.
● Dispersion forces are forces of atrraction that operate between atoms and molecules. They are weak, less than 5% of the strength of covalent bond. Dispersion forces result from an instantaneous uneven distribution of electron density within atoms and molecules.
On average, the electron density in a non-polar molecule (or an individual atom) is evenly distributed. At any one instant, however, the distribution may not be even and an instantaneous dipole will result. The instantaneous dipole will then cause the electrons in a neighboring molecule to arrange themselves so that the forces is attractive.
An instantaneous dipole of this sort is also called an induced dipole. Dipoles flicker in and out of existence, inducing dipoles in other molecules in their vicinity. All these dipoles adjust to maintain an attractive force between the molecules by attracting or repelling electron density in the adjacent molecules. The force between the instantaneous dipole of one molecule and that of another is called the dispersion force.
● Dispersion forces increase with increasing polarizability of the molecule concerned. Polarizability measures how easily the electron density is distorted when subjected to an external electric field. It depends on a number of factors; for example polarizability generally increases with the surface area of the molecule and with the number of electrons present.
● In the elements of Group 18, dispersion forces are the only forces of attraction which operate between atoms. As a result, melting and boiling points are extremely low, reflecting the weakness of these forces. The values of the melting and boiling points increase with increasing atomic number. The atomic number indicates the number of electrons present and is hence a rough measure of the polaizability of the atom concerned.
● The elements of the halogens (Group 17) exists as diatomic molecules, denoted generally as X2. There is a clear trend of increasing melting and boiling points with increasing atomic number and hence increasing numbers of electrons. Melting and boiling points of the halogens are higher overall than those of the noble gases (Group 18).
The reason for this difference is that the halogen molecule consists of two atoms with a covalent bond between them. The electron density in halogen molecule is more spread out than that in noble atom and halogen molecule is therefore more polarizable.
● The most significant intermolecular forces present in water is hydrogen bonding. The effect of the hydrogen bonds is for water H2O to have a significantly higher boling point than the other hydrides of Group 16 (H2S, H2Se, and H2Te).
The steady upward trends in boiling point for the last three substances (H2S, H2Se, and H2Te) is due to increasing dispersion forces as the number of electrons present increases. Hydrogen bonds are not present in these compounds because the elements sulfur, selenium, and tellurium do not have sufficiently high electronegatively values.
(ii)の答
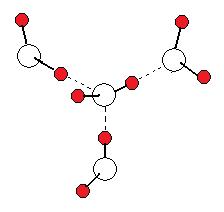 (image579)
(image579)液体の水中で, 水分子内の酸素と共有結合された水素原子は, 1つの結合電子対を分担し他の殻を持たない。結果として, その水素原子は酸素原子よりも著しく小さい。結合された水素原子のδ+電荷はそれゆえ小さい体積に拡がり, 水素原子の極性能力は特別に高くなる。
高い極性のδ+水素原子は隣接の水分子中の小さくて高い電気陰性度の-δに極性化されている酸素原子の電子密度 (一般に孤立電子対) を引き付ける。かくしてその水素は二つの小さくて高電気陰性度の酸素原子の間でサンドウィッチ化され, 液体中の水分子間力が強くなる。
上図(image579)は1つの水分子が液体水中で水素結合によって隣接の3つの水分子と結合されていることを表わす。ここで赤丸は水素原子, 白丸は酸素原子, 実線は共有結合, 点線は水素結合である。
● どんな原子でもそれがより大きな電気陰性度のもう一つ原子に結合されるとき局部的な正電荷 (δ+) を持つ。電子密度はより低い電気陰性度での原子から引き付けらる。
共有的に結合された水素原子は1つの結合電子対を分担し他の殻を持たない。結果として, その水素原子は他の原子よりも著しく小さい。結合された水素原子のδ+電荷はそれゆえ小さい体積に拡がりそしてその極性能力は特別に高い。
高い極性のδ+水素原子は他の分子中の小さくて高い電気陰性度原子から電子密度 (一般に孤立電子対) を引き付ける。そのδ+水素はふたつの小さくて高電気陰性度の原子の間で‘サンドウィッチ’化される; それはひとつの原子に共有的に結合されそして他のものに水素-結合される。
● 水素結合は分子間に形成しそれはひとつの小さい高電気陰性度元素, フッ素, 酸素, あるいは窒素に結合される水素原子を含む。
液体の水では, 隣接の分子の酸素原子に存在する孤立電子対を引き付けるので, 水素結合が形成され, 融点や沸点が増加する。水分子は一緒に群がって凝集し, それは絶えずランダムな衝突の結果として分子を消失したり生成したりする。
Answerof (ii)
 (image579)
(image579)In liquid water, a covalently bonded hydrogen atom in water molecule has a share of one bonding pair of electrons and no other shells.
As a result, the hydrogen atom is significantly smaller than the other oxygen atom bonded. The δ+ charge of the bonded hydrogen atom is therefore spread over a smaller volume and its polarizing power is unusually high.
The highly polarizing δ+ hydrogen atom attracts electron density (commonly a lone pair) on a small, highly electronegativity oxygen atom in adjacent water molecule where is polarizing -δ.
Thus the hydrogen is sandwiched between two small, highly electronegativity oxygen atoms, and intermolecular forces are so strong in liquid water.
Diagram above shows that a water molecule is bonded with adjacent three molecules by hydrogen bonding in liquid water, where red circles are hydrogen atoms, white circles oxygen atoms, solid lines covalent bonds, and dotted lines hydrogen bonds.
● Any atom will have a partial positive charge (+δ) when it is bonded to another atom of greater electronegativity. Electron density is withdrawn from the atom with the lower electronegativity.
A covalently bonded hydrogen atom has a share of one bonding pair of electrons and no other shells. As a result, the hydrogen atom is significantly smaller than other atoms. The δ+ charge of the bonded hydrogen atom is therefore spread over a smaller volume and its polarizing power is unusually high.
The highly polarizing δ+ hydrogen atom attracts electron density (commonly a lone pair) from a small, highly electronegativity atom in another molecule. The δ+ hydrogen becomes ‘sandwiched’between two small, highly electronegativity atoms; it is covalently bonded to one atom and hydrogen-bonded to the other.
● Hydrogen bonds forms between molecules that contains a hydrogen atom bonded to one of the small, highly electronegative elements fluorine, oxygen, or nitrogen.
In liquid water, as δ+ hydrogen atoms attract the lone pairs on oxygen atoms of nearby molecules, hydrogen bonds are formed and so the melting and boiling point increases significantly. Water molecules group together in clumps, which are constantly losing and gaining molecules as a result of random collisions.
問3の答
タンパク質の3次構造は下に述べられているように4つの構造で空間に保持されている。
1. 1次構造 : ポリペプチド鎖のアミノ酸配列で, アミノ酸基の鎖から成る縮重合の高分子を生じる。
2. 2次構造 : ポリペプチド鎖の隣接部分間での水素結合で保持されているαらせんとβひだ付きシート。
3. 3次構造 : 1つのタンパク質分子の重なりで, 離れたアミノ酸間の相互作用で保持されているもの。
4. 4次構造 : 二つ以上の離れたタンパク質の鎖の寄り集まった重なりで, 最終的に生理活性タンパク質を与えるもの。
● タンパク質は天然において縮合高分子で生じ, アミノ酸基の鎖から成り立っている。化学者はポリアミドとしてタンパク質を記述する。タンパク質を記述するのに使用する構造に4つのレベルが存在する : 1次, 2次, 3次, および4次である。
● 1次構造 : ポリペプチド鎖の中のアミノ酸配列。
各アミノ酸はペプチドリンクを通して次々と結合している, それは1つのアミノ酸のカルボキシル基と隣接のアミノ基との間で結合している。1次構造は一般に3文字の省略記号によって表わされる, 例としてアラニンでは ala, ロイシンでは leu などのようにして, 下に示すように, 適当な順番において配列される。
H2N-Ala-Leu-……-Gly-COOH
炭素上の p 軌道と 酸素は, それらはπ結合を形成しているが, 窒素上の p 軌道と, また重なり合うことができ, これはその全ての原子にわたって非極在化した構造を引き起こすように配列されている。この非極在化はペプチドリンクが平面であらねばならない理由である。
● 2次構造 : ポリペプチド鎖の隣接部分間での水素結合で保持されているαらせんとβひだ付きシート。
アミノ酸の鎖は, それは1次構造で出来上がっているのであるが, それ自身二つの方法において重なり合う。このことは互いに隣接しているアミノ酸の配列に依存している。水素結合は空間で重なり構造を保持している。この1次構造の重なりは2次構造と呼ばれている。
● 3次構造 : 離れたアミノ酸間の相互作用で保持されているタンパク質分子の重なり。
より離れたアミノ酸間の相互作用で保持されている鎖の全般わたる重なりが存在している。これは3次構造と呼ばれている。この相互作用は水素結合と2つの硫黄のブリッジ(2つのシスチンアミノ酸の酸化において硫黄原子間で形成する共有結合)を含み, それはまたイオン引力と分子間力を含む。
● 4次構造 : 二つ以上の離れたタンパク質鎖の寄り集まった重なりで, 最終的に整理的活性タンパク質を与えるもの。
いくつかの構造は離れたタンパク質鎖間の相互作用を形成している。これは4次構造と呼ばれている。全てのタンパク質は4次構造ではない, 例えば, ミオグロビンは1つの鎖だけである。ヘモグロビンは4つのタンパク質を含む4次構造を持つ―それは二つのα鎖と二つのβ鎖を持っている。
ポリペプチド鎖で空間に保持されている4つのヘム基 … ヘモグロビンの4次構造は2つのα鎖と2つのβシートから成り, 4面体の角で配列されている。
Answer of Q3
The three dimensional structure of a protein is held in place by four structures as described below.
1. Primary structure : the amino acid sequence in the polypeptide chain, occurred condensation polymers, consisting of chains of amino acid groups.
2. Secondary structure : the alpha helix and beta pleated sheet held by hydrogen bonding between adjacent sections of polypeptide chain.
3. Tertiary structure : folding of a protein molecule held by interactions between distant amino acids.
4. Quaternary structure : fitting together two or more separate protein chains to give the final physiologically active protein.
● Proteins are naturally occurring condensation polymers, consisting of chains of amino acid groups. Chemists would describe a protein as a polyamide.There are four levels of structure used to describe proteins : primary, secondary, tertiary, and quaternary.
● Primary structure : the amino acid sequence in the polypeptide chain.
Each amino acid is joined to the next via a peptide link, which forms between the carboxyl group of one amino acid and the amine group of the next. Primary structure is usually depicted by three-letter short-hand notion, e.g. ala for alanine, leu for leucine, and so on, arranged in the appropriate sequence, as shown below.
H2N-Ala-Leu-……-Gly-COOH
The p orbitals on carbon and oxygen that form the πbond can also overlap with the p orbital on nitrogen, when this is arranged as in the illustration to cause a structure delocalized over all the atoms. This delocalization is the reason why the peptide link must be planar.
● Secondary structure : the alpha helix and beta pleated sheet held by hydrogen bonding between adjacent sections of polypeptide chain.
The chain of amino acids that makes up the primary structure of a protein can fold itself in two ways, depending on the sequences of amino acids that are next to each other. Hydrogen bonds hold the folded structure in place. This folding of the primary structure is called the secondary structure.
● Tertiary structure : folding of a protein molecule held by interactions between distant amino acids.
There is overall folding of the chain held by interaction between more distant amino acids. This is called the tertiary structure. These interactions include hydrogen bonds and disulfide bridges (covalent bonds that form between sulfur atoms on the oxidation of two cysteine amino acids) as well as ionic interactions and intermolecular forces.
● Quaternary structure : fitting together two or more separate protein chains to give the final physiologically active protein.
Some structure results from interaction between separate protein chains. This is called quanternary structure. Not all protein a quaternary structure; myoglobin, for example, has only one chain. Haemoglobine has a quaternary structure that includes four protein chains - it has two alpha chains and two beta chains.
Four haem groups held in place by polypeptide chains … The quaternary structure of haemoglobin consists of two alpha chains and two beta chains arranged at the corners of a tetrahedron.