I
i の答 下図A
 (image607)
(image607)固体イオン化合物: 構造
金属の構造は結晶格子中で等しい大きさの金属イオンから成ることが分かっている。これらの金属イオンの配列に対して4つの基本構造が存在する: 単純立方, 体心立方, 六方最密そして立方最密である。そこで, 一般にイオン化合物の構造は異なる大きさのイオンから成り, 金属構造中の金属イオンと同じように, イオン化合物中のイオンを球として考えることができる。
イオン化合物
イオン化合物の結晶は反対の電荷と普通異なる大きさを持つイオンから作られている。これらのイオンを一緒にした充填は同じ箱にオレンジとグレープフルーツを詰めるときに生ずる似た問題があり, 正負のイオンは反発を最小にそして引力を最大になるように配列されなければならないという付随した複雑性をともなう。
イオン化合物に適合する格子はイオンの相対での数とそれらの大きさに大きく依存している。ここでは, イオン比が 1:1 である2つの基本構造を考える。
岩塩 (塩化ナトリウム) 構造
塩化ナトリウムは岩塩として天然に見つけられる。その構造はイオンの簡単な 1:1 比の化合物としてのありふれたものになっている。塩化ナトリウムの結晶構造は岩塩構造と呼ばれる。各ナトリウムイオンは6つの塩化物イオンによって囲まれている。ナトリウムイオンの配位数は6である。同様に, 各塩化物イオンは6つのナトリウムイオンによって囲まれている。塩化物イオンの配位数もまた6である。注意することはナトリウムイオンが塩化物イオンよりも著しく小さいことである。
もし岩塩構造中の塩化物イオンに注目すると, それらは面心立方配列を形成している。ナトリウムイオンも同様に面心立方配列を形成している。その全体の構造は, ナトリウムイオンと塩化物イオンにおいて, その2種のイオンの重なり合った面心立方配列から成り立っている。
岩塩(NaCl)構造の化合物の例
● I族の金属ハロゲン化物,
● 塩化銀と臭化銀,
● 酸化マグネシウム, 酸化カルシウム, 酸化ストロンチウム, および酸化バリウム,
● 酸化鉄(II), 酸化コバルト(II), および酸化ニッケル(II).
また, この構造はかなり共有性の化合物, 例えば硫化鉛(II) PbS や炭化チタン TiC のようなものにも取り上げられている。
まとめ
● イオン化合物に取り上げられる格子はイオンの相対数とその大きさに依存する。
● 正負のイオンが近似的に等しい大きさである場合は, その構造は塩化セシウム構造に相当し, 2つの重なり合った単純立方配列からなる。
● 岩塩(塩化ナトリウム)構造は2つの重なり合った面心立方配列から成り立つ。その構造はイオン比 1:1 でイオン化合物に対してありふれたものである。
ii の答
各塩化物イオンは6つのナトリウムイオンによって囲まれている。
岩塩 (塩化ナトリウム) 構造
塩化ナトリウムは岩塩として天然に見つけられる。その構造はイオンの簡単な 1:1 比の化合物としてのありふれたもので岩塩構造と呼ばれる。各ナトリウムイオンは6つの塩化物イオンによって囲まれている。ナトリウムイオンの配位数は6である。同様に, 各塩化物イオンは6つのナトリウムイオンによって囲まれている。塩化物イオンの配位数もまた6である。注意することはナトリウムイオンが塩化物イオンよりも著しく小さいことである。
もし岩塩構造中の塩化物イオンに注目すると, それらは面心立方配列を形成している。ナトリウムイオンも同様に面心立方配列を形成している。その全体の構造は, ナトリウムイオンと塩化物イオンにおいて, その2種のイオンの重なり合った面心立方配列から成り立っている。
II
II の答
正負の電極を使用して水溶液の電気伝導をみる。イオン性 NaCl 固体を水に溶かすと, 固体は壊れて Na+ と Cl- のイオンが極性水分子によって取り囲まれ, 自由に動くようになり, その水溶液中に正負の電極をさし込むと, 電位差で電気を導くようになる。
塩化ナトリウムと塩化マグネシウムの両方は室温で結晶固体として存在し, イオン化合物の特性 (例えば, 高融点や水溶液が電気を導くこと) を持つ。
この両方の化合物は反応なしで水に溶ける。固体の結晶格子は壊れそのイオンは極性水分子によって取り囲まれる:
NaCl(s) → Na+(aq) + Cl-(aq)
無水塩化アルミニウムはイオン結晶ではなく, 180℃の比較的低い融点を持ち, 水と激しく反応する (加水分解):
AlCl3(s) + 3H2O(ℓ) → Al(OH)3(s) + 3HCl(aq)
このことは, 無水塩化アルミニウムは分子性塩化物で, その結合は本質的に分散力による分子間結合であることを示している。
他の多くの分子性塩化物 (例えば四塩化ケイ素) も同様に水と激しく反応する:
SiCl4(ℓ) + 4H2O(ℓ) → Si(OH)4(s) + 4HCl(aq)
濃アンモニア水で湿らしたガラス棒を近づけると, 加水分解で生成された塩化水素とアンモニアとの反応で塩化アンモニウムの煙を発する。ここで, (aq) は水溶液を示し, (ℓ) は液体, (s) は固体を示す。
電気伝導
一般に, 電流は電荷粒子が自由に動いているならば電位差で生じる。金属は非極在化の価電子を含んでいるので電気を導く。イオン化合物は溶融するかまたは水に溶かすと自由に動くイオンが生じて電気を導くようになる。固体のイオン化合物はイオンが自由に動かないので電気を導かない。
III
i の答
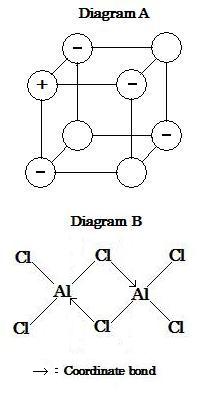
分子中の結合において対で共有された両電子が 同じ原子から供与されるとき, この共有結合は配位結合と呼ばれる。これは図中において矢印で表わされ, 電子対の供与方向を示す。
p ブロックの元素
p ブロックは周期表の中において13族から17族までにある全ての元素を含んでいる。例えば, p-ブロック元素はアルミニウム, ケイ素, リン, 硫黄, および塩素である。それらは非常に活性な非金属から穏やかな性質の金属まで, 非常に幅広い性質を示す。しかしながら, この全ての多様性の中に見つけられるパターンが存在する。
13族から17族までのp-ブロック元素全ての元素の電子構造は希ガスの充満した外殻と不完全な p 副殻の電子構造に対応している。例えば, ケイ素 (周期3, 14族) の電子構造は [Ne]3s23p2 である。加えて, 周期4と5のp-ブロックの元素は d 副殻をもつ, すなわち, ゲルマニウム Ge は [Ar]3d104s24p2 である。また周期6のp-ブロック元素は完全な f 副殻をもつ, すなわち, 鉛 Pb は [Xe]4f145d106s26p2 である。
注意する点は最外殻の軌道は p 軌道であること, その最外殻の s と p の電子の全数は (族の数 - 10) に等しいことである。例えば, 上で挙げられた3つの元素の電子構造は全てが ns2np2 で終わっている。それ故これらの元素の最外殻の s と p の電子の全数は 4 である。16族の硫黄 S の元素は [Ne]3s23p4 の電子構造を持ち, 最外殻の電子数は 16 - 10 = 6 である。
また, 13族から17族まで含む p ブロック元素は不完全な p 軌道を持っている。
13族のアルミニウムの電子構造は Al [Ne]3s23p1 であり, それ故アルミニウム原子は分子形成において3つの電子対が生じる。
例えば, 塩化アルミニウムのルイス構造図 (価電子を点で示す) は式 AlCl3 の分子で 1つのアルミニウム原子に3つの塩素原子が各々共有単結合している。しかしながら, 固体アルミニウムの実際の式は (実験によって決定されるように) Al2Cl6 である。この分子は2つの AlCl3 分子が結合したものである。その理由は以下のように説明される。1つのアルミニウム原子はもう一方のアルミニウム原子にくっ付いている1つの塩素原子の孤立電子対を受け入れ, 希ガスの最外殻電子配置 (8つの電子) と同じようになる。このような結合が配位結合である。 Al2Cl6分子は2つのAlCl3中のアルミニウムと塩素の原子間の2つの配位結合によって形成される。
ii の答
上図B (image607)
iii の答
固体が加熱されるとき, 固体中の粒子間の結合は弱い部分から切断され始めて, その固体は相変化で液体や気体になる。
ケイ素のような結晶固体と比較すると, 塩化アルミニウム固体は AlCl3 や Al2Cl6分子から成り立ちそれらの間で分散力の弱い結合を形成しているので, 比較的低い温度で気化する。
分散力は極性と無極性分子の両方の沸点を考察するときに重要となる。
液体が沸騰するとき, 液体状態の分子間引力の全てに打ち勝つためのエネルギーが要請される。
分散力は分子間に作用する引力である。それらは弱く, 共有結合の5%の強度よりも小さい。分散力は原子や分子内の瞬間的で不均一な電子分布から生じる。平均すると, 無極性分子内の電子密度が均等に分布されている。しかしながら, 一瞬では, その分布は均一ではなく一時的な双極子を生じる。この一時的な双極子により隣接分子間で引き合う力が生じる。この力が分散力である。
この種の一時的な双極子は誘導双極子と呼ばれる。双極子は近辺の他の分子内の双極子を誘導しながら, 現れたり消えたりして揺れている。これらの双極子の全ては隣接分子内の電子密度の引き付けや反発により分子間の吸引力を維持するように調整する。
分散力は関連する分子の極性の増加で増大する。極性は外部電場にさらされるとき電子密度がどのような難易さで歪むかで測定する。それは多くの因子に依存する;例として極性は一般に分子の表面積および存在する電子数にそって増加する。