問1の答 1.4×102
●1 熱化学方程式 (1) を参照すると,
H2(気) + (1/2)O2(気) = H2O(液) + 286 kJ …(1)
1 mol の H2(気) は, 燃焼すると, 286 kJ の熱エネルギーを発生することが分かる。
●2 1 mol の H2(気) の質量は, 原子量を用いると,
1.0×2 = 2 g/mol
●1 と●2 から, 水素ガスの質量 1 g 当りの燃焼エネルギーを X kJ とすると次式が成立する。
(1 g) : (X kJ) = (2 g) : (286 kJ)
よって,
X = 286/2 = 143 = 1.4×102 (有効数字2桁)
問2の答 1.2×102
一致しない。
[理由] 水の状態が結合エネルギーでの反応熱では気体, 式(1)では液体で違うためである。
●1 水素燃焼の反応式は, 反応に関わる物質を全て気体状すると,
H2(気) + (1/2)O2(気) → H2O(気)
この反応に関わる各物質のモル当りの結合エネルギーを, 水素 H-H で X kJ, 酸素 O=O で Y kJ, 水酸基 H-O で Z kJ とし, 発生する反応熱を Q kJ とすると, 近似的に次式が成立する。
Q = 2Z - {X + (1/2)Y}
上式へ, [問題]で与えられた各結合エネルギーの値を代入すると,
Q = 2×463 - {436 + (1/2)×496} = 242
したがって, 水素 1 g 当りの発生する熱エネルギーの値は
(1/2)×242 = 121 = 1.2×102 (有効数字2桁)
●2 一方, 熱化学方程式 (1) を参照して, 水素燃焼の反応式を考えると,
H2(気) + (1/2)O2(気) → H2O(液)
発生する反応熱を Q kJ とすると, Q = 286 となる。したがって, 水素 1 g 当りの発生する熱エネルギーは, 問1の解説のように, 143 となる。
●3 反応熱Qにおいて, ●1の場合と●2の場合を比較すると, 一致しない。この一致しない主なる理由は, 生成される水の状態が, ●1では気体, ●2では液体となっており, 水の状態が異なっているためである。
問3の答 56 kJ
●1 CH4 ガスと水蒸気 H2O の反応からの水素ガス製造の熱化学方程式 (2) は
CH4(気) + 2H2O(気) = 4H2(気) + CO2(気) - 165 kJ …(2)
●2 水の蒸発熱の熱化学方程式は
H2O(液) = H2O(気) - 44 kJ
●3 CH4 ガスと液体 H2O の反応からの水素ガス製造の熱化学方程式は, その反応熱を Q kJ とすると,
CH4(気) + 2H2O(液) = 4H2(気) + CO2(気) + Q kJ
●1と●2の式を使用すると, 反応熱 Q は
Q = {CH4(気) + 2H2O(液)} - {4H2(気) + CO2(気)}
= [{4H2(気) + CO2(気) - 165 kJ - 2H2O(気)} + 2{H2O(気) - 44 kJ}] - {4H2(気) + CO2(気)}
= - 165 kJ - 2×44 kJ = -253 kJ
よって, CH4 ガスと液体 H2O の反応からの水素ガス製造の熱化学方程式は
CH4(気) + 2H2O(液) = 4H2(気) + CO2(気) - 253 kJ
発生水素は 4 mol なので, 4 mol の水素ガスの燃焼熱は, [問題]文中の熱化学方程式 (1) を参照すると
4 mol の水素ガスの燃焼熱 = 4×286 kJ = 1144 kJ
したがって, 1 mol のメタンガス燃焼においては, 実質の発生熱は
1144 kJ - 253 kJ = 891 kJ
1 g 当りでは, メタン CH4 の分子量は 1×12.0 + 4×1.0 = 16.0 なので
891 kJ/(16 g) = 55.6875 = 56 kJ・g-1 (有効数字2桁)
問4の答 H 原子
[理由] Hの1s電子と比べるとLiの2s電子は原子核との距離が大きいのでH原子の方へクーロン力で近づく。
● Li と H の電子配置において,
Li : 1s22s1
H : 1s1
ここで, K殻に存在する H の1s電子と比較すると, L殻に存在する Li の最外殻の2s電子は, Li 原子核からの距離が大きい。したがって, Li 原子と H 原子とが近接すると, その間に存在する Li 原子の最外殻の 2s電子は H原子の方へクーロン力で引きよせられ, 負電荷はH原子の方へ偏る。結果として, 形成された固体 LiH 中の結合はイオン性の共有結合となる。
問5の答 9.6
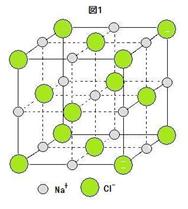
図1を参照して, Cl- の中心を Li の中心, Na+ の中心を H の中心とすると, この立方体の結晶構造内において,
●1 Li 原子数は次のようになる。
立方体の角 : 8×(1/8) = 1個
立方体の面心 : 6×(1/2) = 3個
よって, 合計 4個
●2 H 原子数は次のようになる。
立方体の稜 : 12×(1/4) = 3個
立方体の中心 : 1個
よって, 合計 4個
●3 立方体の体積 V は
V = (2×0.2 nm)3 = (0.4×10-7 cm)3 = 0.064×10-21 cm3 = 6.4×10-23 ml
以上から, この体積 6.4×10-23 ml 中に, H原子は 4個存在し, その質量は (4 g)/(6.0×1023) であるから, 水素 1 g 当りの体積を X ml とすると, 次の比例式が成立する。
1 : X = 4/(6.0×1023) : 6.4×10-23
1 : X = 0.67×10-23 : 6.4×10-23
よって,
X = 9.6 (有効数字2桁)