ヒント
種々の元素は次の宇宙進化の過程で形成された。
地球を基準とした宇宙の実時間(秒)と黒体宇宙背景温度(K)の経過において
●10-43秒(宇宙始点:プランク時代)…〜温度約1032K
ビックバン(爆発的膨張の火の玉状態)の発生, 量子真空(瞬時に出現・消滅する粒子と反粒子の対より成る仮相粒子で満たされ量子ゆらぎがある状態)形成, 力の統一(1つの力より成る), 10-43秒(約1032K)近くで重力の分離による相転移(第1相転移)
初期の量子真空の各物理量の数値は,
シュワルツシルト直径球体 (量子+それを取り巻くエネルギー) の質量m:
m = (hc/2G)1/2 = {(6.63×10-27)(3×1010)/(2×6.67×10-8)}1/2 = 3.86×10-5 = 約10-5g
シュワルツシルト直径L: L = 2R = 4×(6.67×10-8)(3.86×10-5)/(3×1010)2 = 1.14×10-32cm = 約10-32cm
始点ゼロからシュワルツシルト直径までの時間t: t = 1.14×10-32/(3×1010) = 3.80×10-43 = 約10-43秒
シュワルツシルト直径球体の密度d: d = (3.86×10-5)/(1.14×10-32)3 = 約1091g/cm3
温度Tem Tem = (1/3)mc2/k = (1/3)×(3.86×10-5)(3×1010)2/(1.38×10-16) = 8.39×1031 = 約1032K
上の数値は下の各式を使って導かれた。
いま, 初期の量子真空内において, 質量mの粒子と単位質量の粒子間の重力ポテンシャルエネルギーEは, 万有引力定数をGとすると,
E = Gm/R
単位質量の粒子の運動エネルギーTは
T = v2/2
粒子の速度 v は, 脱出の臨界速度とすると,
T = E
よって,
v = (2Gm/R)1/2
速度vは光速cであるので R(シュワルツシルト半径)は,
R = 2Gm/c2
一方, 光速の粒子の波動性を考慮して, その波長をλ(コンプトン波長)とすると,
λ= h/mc
Rの大きさは,
R =λ
また, 質量m は,
m = (hc/2G)1/2
●〜10-36秒…〜温度約1028K
ビックバンは微小な密度ゆらぎと共に光速で膨張, 光エネルギーが支配的な仮想粒子のプラズマスープ
直径Lは, (光速)×(時間)×2 = (3×1010)×(10-36)×2 = 6×10-26 = 約10-25cm
●〜10-35秒 から 10-33秒…〜温度約6.76×1027K から 6.17×1026K
光,電子,クオークなどのスープ形成, 強い力の分離(第2相転移)。
10-35秒でインフレーション発生(火の玉の指数関数的膨張), 密度ゆらぎの拡大, 真空エネルギーの膨大な増加。
10-33秒(約1027K)近くで真空エネルギーの相転移により膨大なエネルギー解放, インフレーション終了 ビックバン生じる。
直径Lは, 10-35秒〜10-33秒の瞬時で, 10-33秒/10-35秒 = 100から e100 = 2.69×1043 の指数関数的膨張によって,
L = (6×10-26)×(2.69×1043) = 16.1×1017 = 約1018cm
●〜数分…〜温度約108K
インフレーション終了時の相転移後, ビックバン膨張
10-10秒(約1015K)近くで弱い力と電磁力の分離による相転移(第3相転移), 弱い力はクオークやレプトンに作用し中性子などの粒子の崩壊の原因となる。
10-4秒において, クオークから陽子 (バリオンの1つ:3つのクオークからなる) や中間子 (メソン:2つのクオークからなる) のハドロンなどが形成される。ニュートリノ, 電子, 光の分離, 中性子とニュートリノの反応で電子と陽子生成
2×102〜3×103秒 後で, 水素プラズマスープ(陽子と電子)形成, 重水素・ヘリウム・リチウムの原子核生成…90%近くが水素のプラズマスープでその中にヘリウム原子核が10%近く存在する。
原子核反応で生成された荷電の原子核の水素, ヘリウム, リチウム, ベリリウム はヘリウム単核種元素 4H の原子量より小い。4H の原子量より大きい原子核はこの時期ではほとんど形成されない。
●〜10万年…〜温度約103K
原子核と電子の凝縮による中性原子(主としてH原子とHe原子)生成
30万年近くで電子の激減によって光子の無散乱が支配的となる。光においての無遮蔽効果。 物質塊形成 光子が束縛から解かれ自由になり直進するようになる。宇宙の晴れ上がり。宇宙マイクロ波放射の背景の原因。
●〜50億年…〜温度約 5K
水素の原始星…密度ゆらぎと重力不安定により形成。 種々の元素…星や星雲の誕生・成長・爆発・死・消滅の循環を通して核反応により生成
10億年前後で原始星(恒星)と惑星, 20億年前後でクェサー(種々の電磁波を放出している明るい天体), 30億年前後で楕円体銀河, 50億年前後で円盤銀河など形成。
○1 太陽質量の1〜3倍の超新星の形成と消滅…HやHeなどのガスを星間に放出してイオン化ガスの惑星状星雲に取り囲まれ酸素Oを含む炭素Cをコアとする太陽質量の約0.6倍の白色わい星になる。白色わい星に連星でHなどの質量が積り太陽質量の約1.4倍以上になると熱核反応暴走で爆発崩壊…ニュートリノと共にC, O, Fe, Co, Niなどの重元素を星間に放出。
○2 太陽質量の3〜30倍の超新星の形成と爆発
太陽質量の3〜8倍の超新星…爆発による完全破壊で星間にH, He, Ne, C, O, Mg, Siなどの元素とニュートリノを放出する。
太陽質量の8〜30倍の超新星…爆発によって星間に各種の元素とニュートリノを放出しコアは鉄に変化するが更に核反応して中性子星(パルサ−)になる。
…○1 と○2 の超新星に関連する現象で生成される元素は, 約100種で周期表の元素とほぼ一致する。鉄より重い多くの元素は超新星の極高温の爆発時に形成される。
○太陽質量の30倍以上の超新星の形成と爆発…ブラックホールになる。
○暗黒物質…ニュートリノ, 白色わい星や中性子星などの冷却した死星, ブラックホール, バリオン(3つのクオークが結合した粒子)の塊や未確認粒子などから成る物質…銀河ハロー(銀河全体を包み込む球状物質)にかなり存在
○暗黒エネルギー
○宇宙線…陽子と電子(大部分), 金属元素(少量), ニュートリノ, γ線, X線, その他
○超新星の命名と分類…命名は, 普通 SN 西暦年 番号 で記述:例 SN 1994D…1994年に発見された4番目の超新星 (順番:A, B,…, aa, ab, …, ba, bb, …)。分類は, I型:そのスペクトルに水素吸収が見られない。II型:そのスペクトルに水素吸収が見られる。
●〜138億年(現在)…〜温度約3K
恒星や超新星の誕生・成長・爆発・死・消滅の循環を通して核反応による各種の元素生成
通常物質:4%, 暗黒物質(ダークマター):26%, 暗黒(ダーク)エネルギー:70%
生命体誕生
●宇宙の未来
宇宙の未来は宇宙密度 Ω=ρ/ρcrit によって決められる。ここで, ρ:宇宙の実際の密度 ρcrit:臨界密度を表し現時点では10‐29g/cm3である。
宇宙密度は次の3つに分けられる。
Ω<1…膨張:最後はビックチル(寒気消滅), Ω>1…収縮:最後はビッククランチ(灼熱破滅)
Ω=1…一定状態を永続:フォーエヴァー(永久継続)
Ωを正確に決めるためには, 宇宙の精度のよい曲率測定とともに, 暗黒物質の正確な確認と新理論の展開が要請されている。
(エドウイン・ハッブルは, 1900年初頭に, 100インチ望遠鏡による天体観測で, 大多数の銀河が地球からかなりの速度で遠ざかっていることを発見した。その銀河の速度Vと地球からの距離Rとは次のような式になる…ハッブルの法則:
V = HR
ここで, ハッブルの定数 H = V/R は, 現在の時刻では次のような値になることが測定された。
H0 = 72±8 km/s/Mpc (A. Riess : 73.24±1.74 km/s/Mpc)
ただし, 1pc = 3.26 光年
また遠い銀河のハッブルの定数は, 遠ければ遠いほどH0値よりずれて大きくなっていることが分かった。このことは, 宇宙は今でも加速的に膨張していることを意味する)
(1992年背景放射探査衛星COBE:コビーと2001年マイクロ波観測衛星WMAP:ダブルマップによって宇宙背景温度2.736K(約3K)とその微小なゆらぎを観測…宇宙始点から30万年後の宇宙の晴天の輻射に関連しており, 宇宙がビックバンのゆらぎとインフレーションによって創生されたことを意味する)
宇宙時間 t[秒]と黒体宇宙背景温度Tem[K] との関係は, 宇宙初期で10-43秒, 1032Kおよび現在で138億年, 2.736Kとして, 次式からおよその値を求めた。
Y = -0.5206697X + 9.6112029
ただし, X = log(t秒), Y = log(Tem絶体温度) において (10-43s, 1032K) → (-43, 32), (138億年, 2.736K) → (17.62, 0.437) とした。
黒体…電磁波の輻射を完全に吸収する壁に囲まれた一定温度の孤立した体積をもつ空間を考える。壁は低温では黒く見え黒体である。その空間では, 平衡状態で, 温度だけに依存する広範囲の電磁波(光)を含む。電磁波の分布状態はプランクの輻射法則に従う。 空洞輻射による実験では, 高温で孤立した磁器などで作られた空間に非常に小さい孔を開けるとその部分が黒体に相当し, 小さい孔からはその温度に対応する電磁波が放出される。
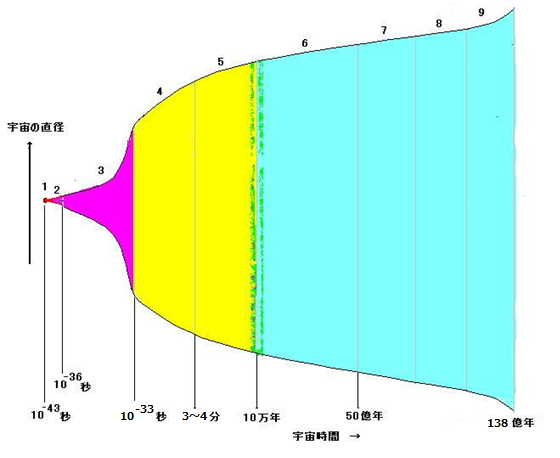
●次図は宇宙進化のプロセスを示している。ただし, 宇宙時間, 宇宙直径, 粒子,星のスケールの大きさは適当にとってある。
1:10-43秒(宇宙始点:プランク時代)…〜温度約1032K
2:〜10-36秒…〜温度約1028K 3::〜10-33秒…〜温度約1027K 4:〜数分…〜温度約108K
5:〜10万年…〜温度約103K 6,7,8::〜50億年…〜温度約5K 9::〜138億年(現在)…〜温度約3K
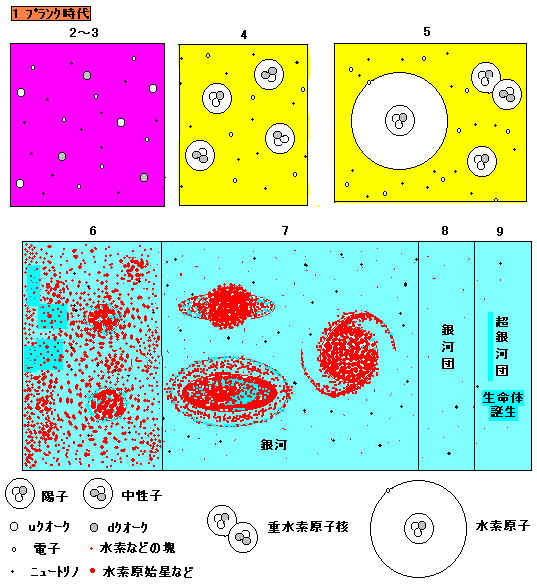
 (image109)
(image109)下図は上図の1〜9において, 横から見た面の粒子や星の状態を表している。
問2
正解…白色領域…典型元素 黄色領域…典型元素 水色領域…遷移元素
ヒント
●典型元素…
○普通, 電子は原子番号の増加とともに最外殻に1個ずつ入っていく。
(例) Li…原子番号:3, 最外殻の電子数:1 Be…原子番号:4, 最外殻の電子数:2 B…原子番号:5, 最外殻の電子数:3 C…原子番号:6, 最外殻の電子数:4など
○価電子の数は, 同じ族において, その族番号の一位の数値と一致する。ただし, 希ガス元素の価電子はゼロとする。
(例) C…族番号14, 価電子数:4 Se…族番号16, 価電子数:6
○物理的・化学的性質が, 同周期において原子番号の増加とともにほぼ段階的に変化する。
(例)電気陰性度…Li:1.0, Be:1.5, B:2.0, C:2.5, N:3.0, O:3.5, F:4.0(全元素中で最大)
○同族の元素は化学的性質が似ている。
(例) 1族の元素は1価の陽イオンになる…H → H+ + e‐ Li → Li+ + e‐ Na → Na+ + e‐ K → K+ + e‐など
● 遷移元素…
○普通, 電子は原子番号の増加とともに内殻に入っていく。
(例) Sc…原子番号:21, M殻:9 Ti…原子番号:22, M殻:10 V…原子番号:23, M殻:11
Cr…原子番号:24, M殻:13(12にならないのは, 3d軌道が5つありその軌道に電子が1つずつ入ると安定化することによる:) Mn…原子番号:25, M殻:13 Fe…原子番号:26, M殻:14など
○価電子は最外殻の電子に相当する。 その数は原子番号が増加しても増加せず, 普通1個か 2個である…規則性がない。
(例) Sc…原子番号:21, 価電子数:2 Ti…原子番号:22, 価電子数:2 V…原子番号:23, 価電子数:2 Cr…原子番号:24, 価電子数:1
○ 族が違っても化学的性質があまり変化しない。
(例) 融点が高い:1100〜1900℃, 陽イオン:+1, +2, +3, 水溶液中では有色錯イオン形成:鉄錯イオン(褐色), コバルト錯イオン(桃色), ニッケル錯イオン(緑色), 銅錯イオン(青色) 硬度・電気伝導度・熱伝導度が大きい。磁性, 触媒性の特質を持つ。
問3
正解…ハロゲン…塩素 アルカリ土類金属…なし アルカリ金属…ナトリウム 希ガス…アルゴン
アクチノイド…プルトニウム ランタノイド…ネオジム
ヒント
●アルカリ金属(1族)…ナトリウムNa, カリウムK, ルビジウムRb, セシウムCs, フランシウムFr
代表的な共通性質:1価の陽イオンになりやすい。非金属のH(周期表の白色領域)を除いた金属典型元素の1族に属する。
●アルカリ土類金属(2族)…カルシウムCa, ストロンチウムSr, バリウムBa, ラジウムRa
代表的な共通性質:2価の陽イオンになりやすい。金属典型元素である。
普通, ベリリウムBeとマグネシウムMgはその性質が他の2族の元素とかなり違うために加えない。(例) BeとMgの水酸化物は水にほとんど溶解しない。水酸化ベリリウムは酸の性質を示す。BeはLi に近い性質を示す。
●ハロゲン(17族)…フッ素F, 塩素Cl, 臭素Br, ヨウ素I, アスタチンAt
代表的な共通性質:1価の陰イオンになりやすい。全て非金属(周期表の白色領域)で典型元素に属する。
●希ガス(18族)…ヘリウムHe, ネオンNe, アルゴンAr, クリプトンKr, キセノンXe, ラドンRn
代表的な共通性質:きわめて安定でイオンになりにくい。価電子がゼロである。全て非金属(周期表の白色領域)で典型元素に属する。
●ランタノイド(3族)…原子番号57〜71の15個の元素で, 57番のランタンLaの物理的・化学的性質にほぼ類似している。遷移金属元素で, ScとYを含めて希土類といわれる。原子番号60のネオジムNdを鉄に添加すると超強磁性体が形成される。
●アクチノイド(3族)…原子番号89〜103の15個の元素で, 全て放射性の遷移金属元素である。核反応によって得られる。原子番号94のプルトニウムPuは核分裂により多量のエネルギーを放出する。
問4
(1)
正解…ア.18 イ.17 ウ.15 エ.16 オ.14 カ.2 キ.13 ク.1
(2)
答…元素の第1イオン化エネルギーは, 第2周期と第3周期のいずれも, 最小値のアルカリ金属を始点として, 原子番号の増加と共に増加し, 希ガスで最大値になる。ただし, 13族と16族のところでいったん減少している。
この傾向は電子配置の観点から次のように説明される。
各元素の電子配置は,
第2周期…Li:1s22s1, Be:1s22s2, B:1s22s22p1, C:1s22s22p2, N:1s22s22p3, O:1s22s22p4,
F:1s22s22p5, Ne:1s22s22p6
第3周期…Na:1s22s22p63s1, Ma:1s22s22p63s2, Al:1s22s22p63s23p1, Si:1s22s22p63s23p2,
P:1s22s22p63s23p3, S:1s22s22p63s23p4 , Cl:1s22s22p63s23p5, Ar:1s22s22p63s23p6
上の電子配置の最外側の電子配置(太文字…第2周期:L殻, 第3周期:M殻)に注目すると,
(1) 最外側にあるL殻とM殻のs軌道(最大電子数:2)とp軌道(最大電子数:6)において, 電子は原子番号(正電荷の陽子)の増加に対して1個ずつ増加している。
(2) (1)から, 原子核中の陽子の増加で, その正電荷の効果が電子間の反発よりも大きくなるために, 最外側のL殻とM殻の電子軌道は縮まることになる。
(3) (2)から, 最外側のL殻とM殻の電子は, 原子核中の陽子が多くなればなるほど, いいかえると原子番号が大きくなればなるほど, 電子間の反発効果が小さい場合に, 原子核との距離が縮小して離れ難くなる。
(4) 以上より, 原子から1番目の電子を離脱するための第1イオン化エネルギーが, 第2と第3周期において, 棒グラフでしめすように, 原子番号が大きくなればなるほど大きくなることを意味する。
○ 第1イオン化エネルギー値が13族と16族のところでいったん減少しているのは,
13族の場合…電子配置は(希ガス構造 + s2) + p1になっている:B:He2s22p1, Al:Ne3s23p1。この場合, (希ガス構造 + s2)中の電子は安定になるが, 最外側にあるp1軌道の電子は逆に不安定になり原子から離れやすくなる。
16族の場合…3個の電子が3種のp軌道(px,py,pz)に1つずつ入ってp軌道全体に広がると安定になる。次に4個の電子がさらにp軌道に入ると4個の電子の内1つは不安定で原子から離れやすい:O:1s22s22p4の2p4中の1個の電子とS:1s22s22p63s23p4の3p4中の1個の電子が離れやすい。また, 6個の電子が3種のp軌道に2つずつ入ると非常に安定化する(希ガスと同じ電子配置)。
問5
正解…Ca…1s22s22p63s23p64s2 Cu…1s22s22p63s23p63d104s1
ヒント
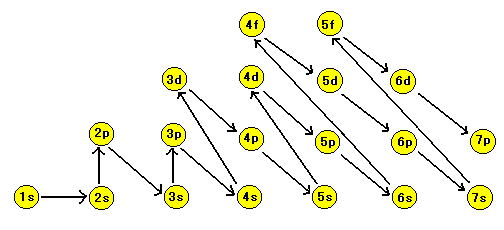
● 原子中の電子は一般に次のように原子核に近い殻の安定した電子軌道から順々に充填される。
● 電子数は, s軌道には最大2, p 軌道には最大6, d 軌道には最大10, f 軌道には最大14である(「パウリの排他律」に関連)。
● 複数個の電子がp 軌道(同じエネルギーレベルのpx,py,pzの3つが存在)に充填される場合, 最初に3つのp 軌道へ1つずつ充填され, 次に, 3つのp 軌道のいずれかに1つずつ充填されていく。そのとき, px,py,pzには, 電子は, それぞれに最大2個入り合計で最大6個になる(「フントの法則」に関連)。
d 軌道(同じエネルギーレベルの軌道が5つ存在)とf 軌道(同じエネルギーレベルの軌道が7つ存在)においてもフントの法則は成立する。
● d 軌道は, 電子が4個または9個の充填よりも5個または10個の充填で安定化する。
問6
答…カルシウムイオンCa2+の水溶液は白く濁って白色沈殿を生じる。銅イオンCu2+の水溶液は濃い青色の溶液に変化する。
上述の変化をCa2+とCu2+の電子配置の観点から考えると次のように説明される。
● Ca2+の水溶液の場合
○ アンモニア水では, 次のように, アンモニアNH3, 水H2O, アンモニウムイオンNH4+, 水酸化物イオンOH-が平衡状態になっている。
NH3 + H2O ? NH4+ + OH-
○ Ca2+水溶液中のカルシウムイオンの電子配置は次に示すように希ガスのアルゴンAr電子配置と同じで, Ca2+は安定化している。
Ca2+:1s22s22p63s23p6
○ Ca2+のアンモニア水溶液では, 正電荷のCa2+と負電荷のOH-が次のようにイオン結合して不溶性の水酸化カルシウムCa(OH)2が白色沈殿する。
Ca2+ + 2OH- → Ca(OH)2
● Cu2+の水溶液の場合
○ Cu2+の電子配置は : Cu2+:1s22s22p63s23p63d9である。
○ Cu2+は過剰のアンモニアの水溶液中ではアンモニアや溶媒などの影響によって次のように1個の3d 軌道と1個の4s 軌道と2個の4p 軌道が混成して4つのdsp2混成軌道をつくる。
dsp2混成軌道のCu2+:1s22s22p63s23p63d84p1(dsp2)0(dsp2)0(dsp2)0(dsp2)0
4つの混成軌道には4個のアンモニア分子NH3(Nに結合に関与する孤立電子対が存在)が正四角形に配位結合し青色の錯イオンのテトラアンミン銅(II)イオン[Cu(NH3)4]2+を形成する。 一般的に, 銅(II)化合物は常磁性であるので, テトラアンミン銅(II)イオン[Cu(NH3)4]2+の中のCu2+は最終的に次のような電子配置をとると考えられる。ただし, dsp2混成軌道の2個の電子はNH3のNの孤立電子対共有によるものである。
[Cu(NH3)4]2+の中のCu2+:1s22s22p63s23p63d74p2(dsp2)2(dsp2)2(dsp2)2(dsp2)2
問7
正解…塩素とナトリウム…化学式:NaCl, イオン結合 塩素と炭素…化学式:CCl4, 共有結合
ヒント
(1) 塩素原子Cl の電子配置は, Cl:1s22s22p63s23p5,
1個の電子を容易に取り入れて塩化物イオンCl-になる。その電子配置は希ガスの安定したアルゴンArの電子配置と同じになる。
Cl-:1s22s22p63s23p6
(2) ナトリウム原子の電子配置は, Na:1s22s22p63s1
1個の電子を容易に放出してナトリウムイオンNa+になる。その電子配置は希ガスの安定したネオンNeの電子配置と同じになる。
Na+:1s22s22p6
したがって, (1)と(2)から, ClとNaが反応すると, 電子e-の授受(酸化還元)が次のように起きて,
Na → Na+ + e-
Cl + e-→ Cl-
最終的にはイオン結合の塩化ナトリウムNaClが生成される。
Na+ + Cl- → NaCl
(3) 炭素原子の電子配置は, C:1s22s22p2
炭素は最外側のL殻のs 電子と p 電子で3種の混成軌道をつくる。
○ sp混成軌道の炭素C:1s22p2(sp)1(sp)1…この場合, 化合物は形成されない。
Cl には, 3p1の不対電子が1個存在する。
また, sp混成軌道のC には, 不対電子が, 2p1の2個と(sp)1の2個の計4個存在する。
したがって, 不対電子同志は結合をしようとする傾向があるから, 4個のCl原子が1個のC原子に結合することが考えられる。しかし, 構造的に不安定で化合物は形成されない。
○ sp2混成軌道の炭素C:1s22p1(sp2)1(sp2)1(sp2)1…この場合, 化合物は形成されない。
sp2混成軌道のC には, 不対電子が, 2p1の1個と(sp2)1の3個の計4個存在する。
したがって, 4個のCl原子が1個のC原子に結合しようとするとするが, 構造的に不安定で化合物は形成されない。
○ sp3混成軌道の炭素C:1s2(sp3)1(sp3)1(sp3)1(sp3)1…この場合, 四塩化炭素 CCl4を形成する。
sp3混成軌道のC には, 不対電子がsp3に4個存在する。
したがって, 4個のCl原子が1個のC原子に共有結合し構造的に安定な正四面体の四塩化炭素 CCl4を形成する。
● 結論として, 18族を除いた周期表において, 左下領域に位置する元素と右上領域に位置する元素が反応すると, イオン結合の化合物になりやすい。
問8
答
(1) 周期表の同周期の典型元素において, 元素の物理的・化学的性質は原子番号の増加に対してほぼ段階的に変化する(問2参照)。
(2) (1)を考慮すると, 14族元素の性質は, 13族と15族の元素を適当な条件で反応させてつくった化合物の性質と同じ傾向になることを意味する。
(3) 14族元素の1つの炭素Cは物質中で最も硬いダイヤモンド(押込み法:硬度10)の成分になる。
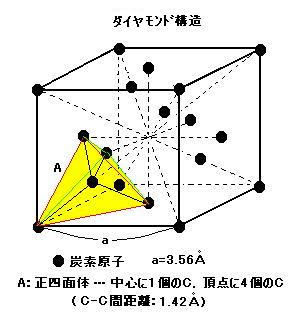
○ ダイヤモンドC結晶構造…1つの炭素原子C中の4つの価電子はsp3混成軌道で隣接する炭素原子Cと強い共有結合で結ばれ, 1つの中心炭素原子に4つの炭素原子Cが正四面体の各頂点に配位している(正四面体形4配位.)。そのようにして炭素原子の結合が次々と3次元に伸びて結晶の巨大分子を形成する。この結晶は, 2組の面心立方格子が組み合わさった構造をしている。単位格子には8個の炭素原子Cが存在し, C-C原子間距離は1.42Å
(4) 13族のホウ素Bと15族の窒素Nを含む窒化ホウ素BNは, 高温でジボラン B2H6 とアンモニアNH3を反応させるとできる。
○ 立方晶窒化ホウ素BN…窒化ホウ素BNを高温・高圧で処理するとダイヤモンド結晶類似構造(せん亜鉛鉱型構造…BとNが半々存在)をもった立方晶窒化ホウ素BNに変化する。硬さはダイヤモンドに匹敵する。