問1の答
(ア. 同じである), (イ. 異なる), (ウ. 構造), (エ. 原子価), (オ. 有機),
(カ. 互変), (キ. 光学), (ク. 幾何), (ケ. 無機)
[配位化合物の異性]
配位化合物に関する異性には, 下に示すように, 多くのものが知られている。
●立体異性(位置異性)
○幾何異性(シストランス異性:当問題参照), ○光学異性(当問題参照), ○平面異性(平面形四配位錯体のシストランス異性)
●構造異性
○イオン化異性…同じ組成を有する2種以上の化合物(塩)において電離で生成する錯イオンの異性
(例) CoClSO4・5NH3…塩:[Co(NH3)5Cl]SO4と[Co(NH3)5SO4]Cl
[Co(NH3)5Cl]SO4 → [Co(NH3)5Cl]2+ + SO42-
[Co(NH3)5SO4]Cl → [Co(NH3)5SO4]+ + Cl-
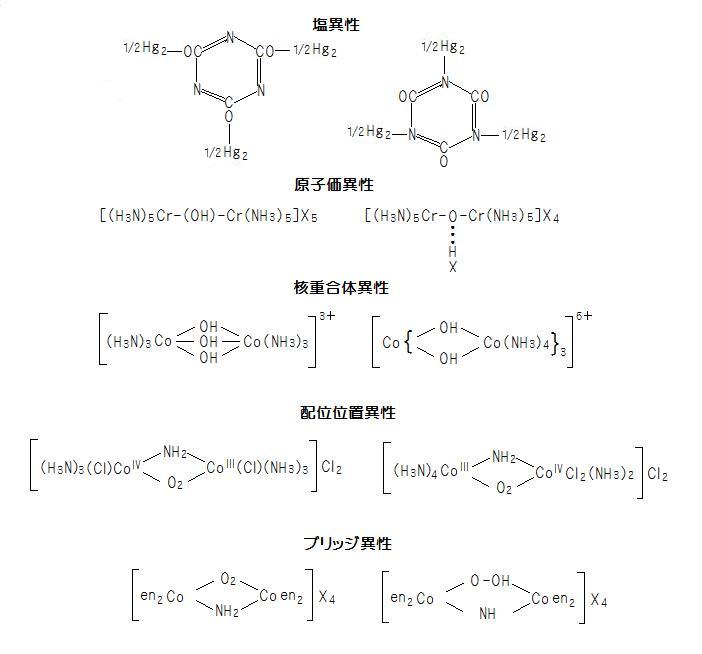
○塩異性…イオン化しない酸基(陽イオン)の構造差による異性
(例) 下図参照(image255)
また, 同じ配位子の中の異なった原子で配位するときに生じる異性
(例) クサント塩[Co(NH3)5NO2]X2とイソクサント塩[Co(NH3)5ONO]X2
○原子価異性…同じ基が異なる原子価力によって結合するために生じる異性
(例) 下図参照
○配位異性…錯陽イオンと錯陰イオンから成る錯体に見られる異性
(例) [Co(en)3][Cr(CN)6]と[Cr(en)3][Co(CN)6], [Cr(NH3)6][Cr(SCN)6]と[Cr(NH3)4(SCN)2][Cr(NH3)2(SCN)4] ただし, en:エチレンジアミン H2NCH2CH2NH2
○水化異性…水分子H2Oが配位子(錯体内)として, または, 単に弱結合の結晶水(錯体外)としてに存在することによって生じる異性
(例) 塩化クロム(III)六水塩:CrCl3・6H2Oで, [Cr(OH2)6]Cl3, [Cr(OH2)5Cl]Cl2・H2O, [Cr(OH2)4Cl2]Cl・2H2O
○重合異性…配位異性, 水化異性の基本形の二量体〜n量体においての異性
(例) (PtCl2・2NH3)nを含む化合物において, n=1:[Pt(NH3)2Cl2], n=2:[Pt(NH3)4][PtCl4]など
{Co(NH3)4(OH)Br2・H2O}nを含む化合物において, n=1:[Co(NH3)4(OH2)(OH)]Br2,
n=2:[(NH3)4Co(OH)2Co(NH3)4]Br4・2H2Oなど その他に核重合体の異性もある(下図参照)
○配位位置異性…錯体内において配位子の総数は不変でそれぞれの金属イオンに配位する仕方が異なるときに生じる異性
(例) μ-ペルオクソ-μ-アミノ-ジクロロヘキサアンミンコバルト(III)コバルト(IV) [Co2(O2)(NH2)(NH3)6Cl2] を含む塩の対称形と非対称形(下図参照)
○配位子異性…錯体内の配位子自身の異性で見られる異性
(例) イソ及びノルマルプロピルアミン C3H9N の配位した [Co(en)2(iso-C3H9N)(Cl)]2+ と [Co(en)2(n-C3H9N)(Cl)]2+
○ブリッジ異性…多核錯塩内のブリッジ配位子の違いで生じる異性
(例) 下図参照
その他
図