[Answer]
a
Answer of i
The electronegativity of an atom as a relative quantity gives a rough measure of its ability to attract a shared electron pair, and is measured on the Pauling scall, ranging from 0.8 for caesium to 4.0 for fluorine.
i の答
原子の相対量としての電気陰性度はシェア―されている電子対を引き付ける能力のおおよその尺度を与え, ポーリングスケールで見積もると, セシュウムでの0.8からフッ素での4.0の範囲にある。
Where a covalent bond exists between two atoms that are not identical, one of the two will have a greater share of the electron pair. unequal shairing happens because different atoms have different powers of attraction for electron pairs.
共有結合が異なった 2つの原子間に存在する場合には, その2つの原子の中の1つがその電子対のより大きなシェア―を占めることになる。等しくないシェア―は異なった原子がその電子対に対し引き付ける異なった力を持つことで生じる。
The electronegativity of an atom gives a rough measure of its ability to attract a shared electron pair. Electronegativity is a relative quantity and is measured on the Pauling scall, ranging from 0.8 for caesium to 4.0 for fluorine.
ある1つの原子の電気陰性度はシェア―されている電子対を引き付ける能力のおおよその尺度を与える。電気陰性度は相対量でありポーリングスケールで見積もると, セシュウムでの0.8からフッ素での4.0の範囲にある。
The atom with the greater electronegativity will have a larger share of the bonding paire of electrons. So the electron density will be skewed towards the more electronegative atom. Thus in the example above, the maximum electron density occurs closer to arsenic (electronegativity 2.2) than to gallium (electronegativity 1.8).
原子はより大きな電気陰性度を持つと結合している電子対のより大きな占有をする。そこでその電子密度はより多くの電気陰性度の原子の方向へ歪められることになる。かくして上述の例において, 最大の密度は電気陰性度1.8のガリウムよりも電気陰性度2.2のヒ素に接近して生じる。
Answer of ii
The boiling points from HCl to HI increase steadily, because the dispertion forces increase as the number of electrons in a molecule of each of HCl, HBr, and HI increases.
ii の答
HCl から HI までの沸点は段階的に増加するが, その理由は HCl, HBr および HI の各1分子中の電子数が増加するのでその分散力が増加することになるからである。
There is a clear trend in electronegativity in the periodic table. Non-metals are elements that gain electrons to complete their outer shells. They have greater electronegativity values than metals, which lose electrons to achieve full ouer shells.
電気陰性度のはっきりした傾向が周期表に存在する。非金属は電子を得てその外殻を満たす元素である。それらは, 電子を失って外殻を満たす金属とりもより大きな電気陰性度を持つ。
Electronegativity values generally decrease as atomic number increases down a group. They increase as atomic number increases across a period. The electronegativity of the halogens (Group VII) decreases in the order
F > Cl > Br > I
電気陰性度の値は一般に原子番号が族にそって大きくなるにつれ減少する。それらは原子番号が周期にそって大きくなると増加する。ハロゲン(VII族)の電気陰性度は次の順番で減少する。
F > Cl > Br > I
All these elements have greater electronegativity values than hydrogen, with the result that the hydrogen halides HX are polarized Hδ+ ―Xδ-. Fluorine is the most electronegativity of the halogens. As a result the H−F bond is polarized to a greater extent than in the other hydrogen halides. The order of decreasing bond polarity is
H―F > H―Cl > H―Br > H―I
これらの全ての元素は一般に水素より大きな電気陰性度を持ち結果としてハロゲン化水素 HX は Hδ+ ―Xδ- のように極性化される。フッ素はハロゲンの中で最も大きな電気陰性度である。結果として H−F 結合は他のハロゲン化水素よりもより大きな範囲に極性化される。結合の極性化減少の順位は
H―F > H―Cl > H―Br > H―I
である。
Hydrogen chloride, like all the hydrogen halides, has a polar covalent bond. It is said to be a polar molecule. The overall molecule has a dipole, that is, a polar of separated charges of opposite sign. Because the positive end of one molecule is attracted to the negative end of another, polar molecules interact with each other.
These interactions affect the melting and boiling points of substances, and the types of reaction in which they take part.
塩化水素は, 全てのハロゲン化水素と同じように, 極性共有結合から成る。それは極性分子であるという。分子の全領域は双極子で, いわゆる, 反対記号に分離された荷電の極性子である。ある 1つの分子のプラス端は他の分子のマイナス端に引き付けられるので, 極性分子は相互に引き合う。この相互作用は物質の融点や沸点に影響し, それらが関わり合うという反応の型に属する。
Intermoleclar forces are not simply restricted to dipole- dipole forces. The boiling points of the hydrogen halides reveal that there are two other factors at work.
分子間力は簡単に双極子−双極子力だけで限定されるものではない。ハロゲン化水素の沸点は作用において他の2つの要因が存在していることを表わしている。
First of all, the boilng point of hydrogen fluoride is anomalously high. To fit in which the overall trend in the group, the value should be in the region of -100 ℃, Instead of having the lowest value, it actually has the highest value. The anomalously high boling point of hydrogen fluoride is the result of a special variety of dipole-dipole force called hydrogen bounding.
まず初めに, フッ化水素の沸点は異常に高い。その族の全体の傾向に当てはめると, その値は-100 ℃の範囲になるが, その最も低い値をもつかわりに, 実際にはそれは最も高い値をあらわす。フッ化水素の異常に高い沸点は水素結合と呼ばれる双極子−双極子力の特殊な変化の結果である。
The second consideration refers directly to the magnitude of the dipoles. The dipoles of the hydrogen halides decrease in the order HF > HCl > HBr > HI, as shown in the table.
2番目に考慮することは双極子の大きさを直接に参照することである。ハロゲン化水素の双極子は, 表に示されるように, HF > HCl > HBr > HI の順序で減少する。
The size of the dipole depends partly on the electronegativity of the halogens, which decrease in the sequence F(4.0) > Cl(3.2) > Br(3.0) > I(2.7).
その双極子の大きさは部分的にハロゲンの電気陰性度に依存し, それは F(4.0) > Cl(3.2) > Br(3.0) > I(2.7) の順列において減少している。
Putting the anomalous hydrogen fluoride to one side for the moment, the magnitudes of the other dipoles indicate that dipole-dipole forces should decrease in the order HCl > HBr > HI, with the result that the boilng points should decrease in the same order.
異常なフッ化水素を一時棚上げして, 他の双極子の大きさは双極子−双極子力が HCl > HBr > HI の順序で減少し, その結果で沸点は同じ順序で減少するだろうということを示している。
Hower, the boiling points increase in thid order, i.e. HCl < HBr < HI. There must be another more important, intermoleclar force to consider, that is, the dispersion force between the instantaneous dipole of one molecule and that of another is a type of intermolecular force.
しかし, その沸点は, 即ち, HCl < HBr < HI の順番で増加している。考慮すべすきもう1つのより重要な分子間力が存在しなければならない, いわゆる, 1つの分子の瞬間的な双極子ともう1つのものとの間の分散力が分子間力の型にある。
The boiling points of the hydrogen halides increase from HCl to HI, because the dispertion forces increase as the number of electrons increases. The anomalously high boiling point of HF arises because there is hydrogen bonding between the highly polar molecules. This polarity results from the fact that fluorine is a small, highly, electronegativity element.
ハロンゲン化水素の沸点は HCl から HI までは増加するが, その理由は電子数が増加するにつれて分散力が増加することにある。HF の異常に高い沸点は高い極性分子間に水素結合が存在するからである。この極性はフッ素が小さくて高い電気陰性度の元素であるという事実から生じる。
Answer of iii
The anomalously high boiling point of HF arises because there is hydrogen bonding between the highly polar molecules. This polarity results from the fact that fluorine is a small, highly, electronegativity element.
iii の答
HF の異常に高い沸点はその高い極性分子間に水素結合が存在するからである。この極性はフッ素が小さくて高い電気陰性度の元素であるという事実による。
Answer of b
The electronic structures in shorter form for carbon and oxygen are represented as follows;
C 1s22s22p2(2px12py1) O 1s22s22p4(2px22py12pz1)
It is found that there are some 2p1 orbitals in each of the electronic structures of carbon and oxygen. The two 2p1 orbitals, that is, the two lobes of which have opposite phase, can overlap in two ways bellow.
i (a σ bond) First, they overlap end-on, giving rise to a σ bonding molecular orbital when the overlapping lobes are in phase, and a corresponding antibonding orbital σ* out of phase.
ii (a π bond) Second, the p orbital at right angles to σ bond may overlap sideways. This arrangement gives rise to a πbonding orbital when the orbitals are in phase, and a corresponding antibonding orbital π*out of phase.
b の答
炭素と酸素の簡単形の電子構造は次のように表される ;
C 1s22s22p2(2px12py1) O 1s22s22p4(2px22py12pz1)
炭素と酸素の電子構造の各々にはいくつかの2p1軌道が存在することが分かる。その2つの2p1軌道, いわゆる, 反対の位相を持つ2つの衝突球は, 下のような2つの仕方で重なり合うことができる。
i (σ 結合) 最初に, それらは端っこで重なり, 重なり合う衝突球が同位相にあるときσ結合の分子軌道を生じ, そして異位相では相対する反結合軌道σ*を生じる。
ii (π 結合) 二番目に, σ結合に直角なp軌道が横で重なり合う。この配置は軌道が同位相のときπ結合軌道を生じ, 異なった位相では相対する反結合軌道 π*を生じる。
A convenient way to represent electronic structures is a notation known as 'electrons-in-boxes'. This notation shows each orbital as a box and the electrons as arrows in the boxes. The opposite spin of paired electrons is shown by arrows facing in opposite directions (usually up and down).
電子構造を表わす便利な方法は'箱の中の電子'として知られる表記がある。この表記は各軌道を箱としてそしてその電子を矢印として箱の中に示す。電子対の反対のスピンは反対方向に面した矢印によって表わされる (普通上下で示す)。
Although the 'electrons-in-boxes' notation is a useful visiual aid, it is a tedious way to depict electronic sructure routinely. We need an easier, shorter form. More usually, the occupied subshells are written in order of increasing energy with the number of electrons following as a superscript.
'箱の中の電子'の表記は有益な視覚的助けであるけれども, 決まり切った電子構造を表わす退屈な方法である。もっと容易で短い型を必要とする。よく使われるのは, 充填された副殻が増加エネルギーの順においてそれに従う電子の数を右肩表記として記述される。
For example, when there is only one electron in the 1s orbital, we write this as 1s1;similarly, 1s2 means two electrons are in the 1s orbital;and 2p6 means six electrons are in the 2p subshell (two each in the 2px, 2py, and 2pz orbitals).
For example, the electronic structures in shorter form for the elements carbon and oxygen are represented as follows;
C 1s22s22p2(2px12py1) O 1s22s22p4(2px22py12pz1)
例として, 1s軌道の中に1つの電子のみが存在するとき, これを 1s1 として書く ; 同様に, 1s2 は 2つの電子が1s軌道にあることを意味する ; そして 2p6 は 6つの電子が 2p副殻 (2px, 2py, および 2pz の各々に2つ) にあることを意味する。
例として, 短い形の電子構造は元素の炭素と酸素に対して次のように表わされる ;
C 1s22s22p2(2px12py1) O 1s22s22p4(2px22py12pz1)
The overlap of two s orbitals produces a sigma (σ) bonding orbital when the two orbitals are in phase and a corresponding sigma star (σ*) antibonding orbital when they are out of phase. Two electrons in a sigma bonding molecular orbital form a sigma bond.
2つのs軌道の重なりはその2つの軌道が同じ位相にあるとシグマ(σ)結合軌道そして違った位相であるときはシグマスター(σ*) 反結合軌道を生じる。
There are two possible ways in which two p orbitals, the two lobes of which have opposite phase, can overlap.
2つのp軌道が反対の位相を持つ衝突の球として重なるときには, それにおいて, 2つの可能な方法が存在する。
The first possibility is that they overlap end-on, giving rise to a sigma (σ) bonding molecular orbital when the overlapping lobes are in phase. (There will always be a corresponding antibonding orbital (σ*) when the overlapping lobes are out of phase.)
最初は次のように説明される。それらがその重なる衝突球が位相内であるとき, 端で重なり, シグマ(σ)結合分子軌道を生じる。(その重なる衝突球が位相外にあるときは対応する反結合軌道(σ*)が常に存在することになる。)
The second possibility is that the p orbital at right angles to a sigma bond may overlap sideways. This arrangement gives rise to a pi (π) bonding orbital when the orbitals are in phase. (Again, there is a corresponding antibonding orbital (π*) when the orbitals are out of phase.)
二番目の可能性は次のようになる。シグマ結合に直角のp軌道は横で重なりあう。この配列はその軌道が同位相にあるときパイ(π)結合軌道を生じる。(さらに, その軌道が違った位相にあるとき対応する反結合軌道(π*)が存在する。)
Two electrons in a pi bonding moleclar orbital form a pi bond. A pi bond is found in association with a sigma bond in molecules that contain a double covalent bond, such as ethene C2H4.
● A sigma molecular orbital is symmetrical about the internuclear axis (the imaginary line between the nuclei).
● A pi molecular orbital has a nodal plane (a plane in which the electron density is zero) along the internuclear axis.
パイ結合分子軌道の中の二つの電子はパイ結合を形成する。パイ結合は分子中のシグマ結合と一緒に見られ, それは, ちょうどエチレンのように, 二重共有結合を含む。
● シグマ分子軌道は核間の軸(核の間に想定された線)において対称である。
● パイ分子軌道はその核軸にそって盛り上がり平面(その電子密度がゼロである平面)をもっている。
c
Answer of i
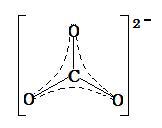 (image603)
(image603)(The shape is trigonal planar. Delocarization is shown using dashed lines.)
c
i の答
 (image603)
(image603)(形は三角平面である。非極在化はダッシュ線を使用して示されている。)
Delocalization in ions
The electrostatic potential map for ethanoic acid CH3COOH shows that one of the oxygen atoms is bonded a hydrogen atom and that the other oxygen atom is in a diffrent environment. The carbon-oxygen double bond is strongly polar.
イオンの中の非極在化
酢酸 CH3COOH の静電気的ポテンシャル図はその酸素原子の1つが水素原子に結合しそして他の酸素原子は異なった環境にあることを示している。その炭素−酸素2重結合は強い極性である。
When a hydrogen ion H+ is lost from ethanoic acid to form the ethanoate ion, the electron density shows a significant change has occurred. A simplistic analysis would suggest the formla CH3COO-.
水素イオンが酢酸から失われ酢酸イオンを形成するときその電子密度は顕著な変化が生じたことを示している。1つの簡単な分析は式 CH3COO- を提示する。
However, the electron density shows that the two oxygen atoms are no longer diffrent. It is impossible to tell either oxygen atom to which the hydrogen was attached or which was the doubly bonded one. The ion is much better represented by the formula CH3CO2-, the two oxyzens now being equivalent and stabilized in the solution.
しかし, その電子密度は2つの酸素原子には何の違いもないことをしめす。水素原子がくっ付いている酸素原子なのかあるいは2重結合のものなのかの何れかを説明することは不可能である。そのイオンは式 CH3CO2- によって表わされるのがよりベターであり, その2つの酸素原子は現に等価で溶液中で安定である。
The carbonate ion CO32- are delocalized ; its shape is trigonal planar. The double bond contained in the carbonate ion is delocalized between the three oxygen atoms and the carbon atom.
炭酸イオン CO32- は非極在化されており, その形は三角平面である。炭酸イオン中に含まれる2重結合は3つの酸素原子と1つ炭素原子の間に分散されている。
Answer of ii
The one p orbital per atom is delocalized to form the equivalent bonds between the three oxygen atoms and the carbon atom in the carbonate ion, and those between the six carbon atoms in the benzene molecule.
ii の答
原子当りの1つのp軌道は非極在化されて炭酸イオン中の3つの酸素原子と1つの炭素原子間に等価な結合およびベンゼン分子中の6つの炭素原子間に等価な結合を形成する。
Delocalization in benzene
The electronic structure of carbon is C 1s22s22p2. The one p orbital per atom not so far used in bonding projects above and below the plane of the hexagonal ring. The p orbitals on adjacent carbon atoms overlap to form molecular orbitals which are spread over all six carbon atoms.
ベンゼンの非極在化
炭素の電子構造は C 1s22s22p2 である。結合にそれまで使用されていない原子当りのその1つのp軌道は六角形リングの上下に突き出ている。そのp軌道は接した炭素原子上で重なり6つの炭素原子の全てにわたって拡がり分子軌道を形成する。
The lowest-energy molecular orbital is shaped like two hexagonal doughnuts positioned above and below the plane of the ring.
The pair of electrons in the molecular orbital bonds all six carbon atoms together. There are also two other bonding molecular orbitals of more complicated shape each containing a pair of electrons.
その最低エネルギーの分子軌道はリング平面の上下に位置する2つの六角形のドーナツのように形づける。その分子軌道の電子対は全ての6つの炭素原子を一緒にくっ付ける。また2つの他の結合に関与しているもっと複雑な形の分子軌道が存在し各々1つの電子対を含む。