[Answer]
I
Answer of i Diagram A below
 (image607)
(image607)IONIC SOLID: STRUCTURE
We have seen that metallic structures consist of equal-sized ions packed into crystalline lattice. There are four basic structures for arranging these metal ions: simple cubic, body-centered cubic, hexagonal close packing, and cubic close packing. So how do ionic substances, consisting of ions of generally different sizes, pack into regular lattices ? As with metal ions in metallic structures, we can also think of the ions in ionic compounds as being spherical.
Ionic compounds
The crystals of ionic compounds are made up of ions that have opposite charges and generally different sizes. Packing these ions together presents a similar problem to packing oranges and grapefruit in the same box, with the additional complication that the positive and negative ions must be arranged to minimize repulsions and maximize attractions.
The lattice adopted by ionic compounds depends largely on the relative numbers of ions and on their sizes. In this spread, we shall consider in detail two basic structure in which the ion ratio is 1 : 1.
The rock-salt (sodium chloride) structure
Sodium chloride is found naturally as rock salt. The crystal structure of sodium chloride is called the rock-salt structure. Each sodium ion is surrounded by six chloride ions. The coordination number of the sodium ion is 6. Similarly, each chloride ion is surrounded by six sodium ions. The coordination number of the chloride ion is also 6. Note that the sodium ion is significantly smaller than the chloride ion.
Look carefully at the diagram below. If we think just about the chloride ions in the rock-salt structure, we can see that they form a face-centered cubic array. The sodium ions similarly form a faced-centered cubic array. The overall structure consists of two interpenetrating face-centered cubic arrays, one of sodium ions and one of chloride ions.
Diagram
Unit cell Detail
The rock-salt (sodium chloride) structure
Compounds with the rock-salt (NaCl) structure
The rock-salt structure is by far the most common structure for compounds with a simple 1: 1 ratio of ions. Examples include:
● seventeen Group I metal halides,
● silver chloride and silver bromide,
● magnesium oxide, calcium oxide, strontium oxide, and barium oxide,
● iron(II) oxide, cobalt(II) oxide, and nickel(II) oxide.
The structure is also adopted by compounds which show considerable covalent character, such as lead(II) sulfide PbS and titanium carbide TiC.
Summary
● The lattice adopted by ionic compounds depends on the relative numbers of ions and on their sizes.
● Where the positive and negative ions are of approximately equal size, they may pack into the caesium chloride structure.
● The caesium chloride structure consists of two interpenetrating simple cubic arrays.
● The rock-salt (sodium chloride) structure consists of two interpenetrating face-centered cubic arrays.
● The rock-salt structure is by far the most important for compounds with a 1: 1 ion ratio.
Answer of ii
Each chloride ion is surrounded by six sodium ions.
The rock-salt (sodium chloride) structure
Sodium chloride is found naturally as rock salt. The crystal structure of sodium chloride is called the rock-salt structure. Each sodium ion is surrounded by six chloride ions. The coordination number of the sodium ion is 6. Similarly, each chloride ion is surrounded by six sodium ions. The coordination number of the chloride ion is also 6. Note that the sodium ion is significantly smaller than the chloride ion.
About the chloride ions in the rock-salt structure, we can see that they form a face-centered cubic array. The sodium ions similarly form a faced-centered cubic array.
The overall structure consists of two interpenetrating face-centered cubic arrays, one of sodium ions and one of chloride ions.
II
Answer of II
It is a simple test to show the electric conductivity of water solution using electrodes.
When ionic NaCl solid dissolves in water, the solid breaks down and the ions of Na+ and Cl- are surrounded by the polar water, free to move and to conduct electricity by electrodes.
Sodium chloride and magnesium chloride both exist as crystalline solids at room temperature, and have the typical properties of ionic compounds (e.g., high melting point and aqueous solution conducts electricity).
These compounds both dissolve in water without reaction. The solid crystalline lattice breaks down and the ions are surrounded by the polar water molecules:
NaCl(s) → Na+(aq) + Cl-(aq)
Anhydrous aluminum chloride is not crystalline, has the relatively low melting point of 180℃, and reacts violently with water:
AlCl3(s) + 3H2O(ℓ) → Al(OH)3(s) + 3HCl(aq)
Many other covalent chlorides (e.g. silicon tetrachloride) react similarly with water:
SiCl4(ℓ) + 4H2O(ℓ) → Si(OH)4(s) + 4HCl(aq)
This behavior suggests that the bonding in anhydrous aluminum chloride is also essentially covalent. The reaction between silicon tetrachloride and water is vigorous. The glass rod is moistened with concentrated aqueous ammonia, which produces white fumes with the hydrogen chloride produced on hydrolysis.
Hydrolysis
Reactions with water are referred to as hydrolysis reactions. The bracket (aq) indicates an aqueous solution; the bracket (ℓ) indicates a liquid.
Electrical conductivity
In general terms, an electric current will flow if charged particles are free to move when an electric potential difference is applied. Metals conduct electricity because they contain delocalized valence electrons.
Ionic compounds conduct electricity when molten or when dissolved in water. In both cases, the electric current is carried by ions that are free to move. Solid ionic compounds do not conduct electricity because the ions cannot move freely.
III
Answer of i
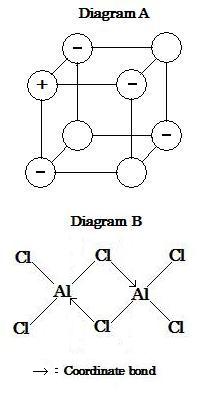
When both of electrons in the shared pair of bond in a molecule are originated from the same atom, the covalent bond is called as coordinate bond (or coordinate covalent bond, or dative covalent bond). This may be represented as an arrow in diagram, which shows the direction of the electron pair donation.
THE P BLOCK ELEMENTS
The p block includes all elements in Groups III to VII inclusive in the periodic table. For example, the p-block elements are aluminum, silicon, phosphorus, sulfur, and chlorine. They show an enormously wide range of properties, from highly reactive non-metals, to mildly reactive metals. However, there are patterns to be discovered among all this variety.
Electronic structures
The electronic structure of all p-block elements in Groups III to VII corresponds to the electronic structure of a noble gas together with a full outer shell and an incomplete p subshell. For example, the electronic structure of silicon Si (Period 3, Group IV) is [Ne]3s23p2. In addition, the p-block elements of Periods 4 and 5 have d subshell, e.g. germanium Ge is [Ar]3d104s24p2. The p-block elements of period 6 also have a complete f subshell, e.g. lead Pb is [Xe]4f145d106s26p2.
Two points that you should note are that the outermost orbitals are p orbitals, and that the total number of s and p electrons is equal to the group number. For example, the electronic structures of the three elements given above all end with ns2np2. Each of these elements is therefore a member of Group IV (i.e. 2 + 2 = 4). The element sulfur S has the electronic structure [Ne]3s23p4 and is therefore a member of Group VI.
The p-block elements in Groups III to VII inclusive have incompletely filled p orbitals.
Aluminum is Group III of the periodic table (i.e. Group XIII of the long form). The electronic structure of aluminum is Al [Ne]3s23p1 and so each atom can be only contribute to three pairs of electrons in a molecule. Drawing the Lewis structure of aluminum chloride results in a molecule of formula AlCl3 with three chlorine atoms each joined by a single covalent bond to an aluminum atom. However, the actual formula of solid aluminum chloride (as determined by experiment) is Al2Cl6. This molecule consists of two AlCl3 molecules joined together. The illustration below shows how this arrangement is achieved. Each of the aluminum atoms accepts a share in a lone pair of electrons donated by a chlorine atom attached to the other aluminum atom. Such bond is referred to as a coordinate bond, which shown the direction of the electron pair donation. A molecule of Al2Cl6 is formed by the each coordinate bond between atoms of aluminum and chlorine in two AlCl3.
Answer of ii
Diagram B above (image607)
Answer of iii
In heating of a solid, bonds between particles in solid begin to be broken from a region of weak bonding in solid, and the solid is converted into liquid or gas by state changing.
Compare with the crystal solids like silicon.
As solid aluminum chloride consists of molecules of AlCl3 and Al2Cl6 to form the weak bonds of dispersion force between them, the chloride vaporizes at a relatively low temperature.
Dispersion forces are significant when considering the boiling points of both polar and non-polar molecules.
When a liquid boils, energy is required to overcome all the forces of attraction between the molecules in the liquid state.
Dispersion forces are forces of attraction that operate between atoms and molecules. They are weak, less than 5% of the strength of covalent bond. Dispersion forces result from an instantaneous uneven distribution of electron density within atoms and molecules. On average, the electron density in a non-polar molecule (or an individual atom) is evenly distributed. At any one instant, however, the distribution may not be even and an instantaneous dipole will result. The instantaneous dipole will then cause electrons in a neighboring molecule to arrange themselves so that the forces is attractive.
An instantaneous dipole of this sort is also called an induced dipole. Dipoles flicker in and out of existence, inducing dipoles in other molecules in their vicinity. All these dipoles adjust to maintain an attractive force between the molecules by attracting or repelling electron density in the adjacent molecules. The force between the instantaneous dipole of one molecule and that of another is called the dispersion force.
Dispersion forces increase with increasing polarizability of the molecule concerned. Polarizability measures how easily the electron density is distorted when subjected to an external electric field. It depends on a number of factors; for example polarizability generally increases with the surface area of the molecule and with the number of electrons present.
化学問題 2-1
[答]
I
i の答 下図A
 (image607)
(image607)イオン固体: 構造
金属の構造は結晶格子中で等しい大きさのイオンから成ることが分かっている。これらの金属イオンの配列に対して4つの基本構造が存在する: 単純立方, 体心立方, 六方最密そして立方最密である。そこで, 一般に異なる大きさのイオンから成る, イオン物質は規則正しい格子中にどのように積み重なるのか?金属構造中の金属イオンと同じように, イオン化合物中のイオンを球として考えることができる。
イオン化合物
イオン化合物の結晶は反対の電荷と一般に異なる大きさを持つイオンから作られている。これらのイオンを一緒にした充填は同じ箱にオレンジとグレープフルーツを詰めるときに生ずる似た問題があり, 正負のイオンは反発を最小にそして引力を最大になるように配列されなければならないという付随した複雑性をともなう。
イオン化合物に適合する格子はイオンの相対での数とそれらの大きさに大きく依存している。この章では, イオン比が 1:1 である2つの基本構造を詳細に考える。
岩塩 (塩化ナトリウム) 構造
塩化ナトリウムは岩塩として天然に見つけられる。塩化ナトリウムの結晶構造は岩塩構造と呼ばれる。各ナトリウムイオンは6つの塩化物イオンによって囲まれている。ナトリウムイオンの配位数は6である。同様に, 各塩化物イオンは6つのナトリウムイオンによって囲まれている。塩化物イオンの配位数もまた6である。注意することはナトリウムイオンが塩化物イオンよりも著しく小さいことである。
下の図で注意深く見て, もし岩塩構造中の塩化物イオンについてちょうど考えると, それらは面心立方配列を形成していることが分かる。ナトリウムイオンも同様に面心立方配列を形成している。その全体の構造は, ひとつのナトリウムイオンとひとつのイオンにおいて, 2つの重なり合った面心立方配列から成り立っている。
図
単位格子 詳細
岩塩 (塩化ナトリウム) 構造
岩塩(NaCl)構造の化合物
岩塩構造はイオンの簡単な 1:1 比の化合物に対して超最多のありふれた構造になっている。例は次のものを含む :
● 17のI族の金属ハロゲン化物,
● 塩化銀と臭化銀,
● 酸化マグネシウム, 酸化カルシウム, 酸化ストロンチウム, および酸化バリウム,
● 酸化鉄(II), 酸化コバルト(II), および酸化ニッケル(II).
この構造はまたかなり共有の性質を示す化合物, 例えば硫化鉛(II) PbS や炭化チタン TiC のようなものにも採用される。
まとめ
● イオン化合物に取り上げられる格子はイオンの相対数とその大きさに依存する。
● 正負のイオンが近似的に等しい大きさである場合では, それらは塩化セシウム構造に積み重なる。
● 塩化セシウム構造は2つの重なり合った単純立方配列からなる。
● 岩塩(塩化ナトリウム)構造は2つの重なり合った面心立方配列から成り立つ。
● 岩塩構造は 1:1 イオン比の化合物に対して非常に重要なものである。
ii の答
各塩化物イオンは6つのナトリウムイオンによって囲まれている。
岩塩 (塩化ナトリウム) 構造
塩化ナトリウムは岩塩として天然に見つけられる。塩化ナトリウムの結晶構造は岩塩構造と呼ばれる。各ナトリウムイオンは6つの塩化物イオンによって囲まれている。ナトリウムイオンの配位数は6である。同様に, 各塩化物イオンは6つのナトリウムイオンによって囲まれている。塩化物イオンの配位数もまた6である。注意することはナトリウムイオンが塩化物イオンよりも著しく小さいことである。
岩塩構造中の塩化物イオンについて, それらは面心立方配列を形成していることが分かる。ナトリウムイオンも同様に面心立方配列を形成している。その全体の構造は, ひとつのナトリウムイオンとひとつのイオンにおいて, 2つの重なり合った面心立方配列から成り立っている。
II
II の答
電極を使用して水溶液の電気伝導をみることが簡単な実験である。
イオン性NaCl固体が水に溶けるとき, 固体は壊れて Na+ と Cl- のイオンが極性水分子によって取り囲まれ, 自由に動くようになりそして電極で電気を導くようになる。
塩化ナトリウムと塩化マグネシウムの両方は室温で結晶固体として存在し, イオン化合物の特性 (例えば, 高融点や水溶液が電気を導くこと) を持つ。
この両方の化合物は反応なしで水に溶ける。固体の結晶格子は壊れそのイオンは極性水分子によって取り囲まれる:
NaCl(s) → Na+(aq) + Cl-(aq)
無水塩化アルミニウムは結晶ではなく, 180℃の比較的低い融点を持ち, 水と激しく反応する:
AlCl3(s) + 3H2O(ℓ) → Al(OH)3(s) + 3HCl(aq)
他の多くの共有性塩化物 (例えば四塩化ケイ素) も同様に水と反応する:
SiCl4(ℓ) + 4H2O(ℓ) → Si(OH)4(s) + 4HCl(aq)
この挙動は無水塩化アルミニウムの結合もまた本質的に共有性であることを示している。四塩化ケイ素と水の間の反応は激しい。そのガラス棒は濃アンモニア水で湿らすと, 加水分解で生成される塩化水素で煙を発する。
加水分解
水との反応は加水分解反応としてみなさられる。かっこ (aq) は水溶液を示し, かっこ (ℓ) は液体を示す。
電気伝導
一般に, 電流は電荷粒子が自由に動いているならば電位差が適用されると流れる。金属は非極在化の価電子を含んでいるので電気を導く。イオン化合物は溶融するかまたは水に溶かすと電気を導く。両方とも, 電流が自由に動くイオンによって運ばれる。固体のイオン化合物はイオンが自由に動かないので電気を導かない。
III
i の答
分子中の結合の対で共有された両電子が 同じ原子に起因するとき, この共有結合は配位結合 (あるいは配位共有結合, あるいは付与共有結合) と呼ばれる。これは図中において矢印で表わされ, 電子対の付与方向を示しす。
p ブロックの元素
p ブロックは周期表の中においてIII族からVII族までにある全ての元素を含んでいる。例えば, p-ブロック元素はアルミニウム, ケイ素, リン, 硫黄, および塩素である。それらは非常に活性な非金属から穏やかな性質の金属まで, 非常に幅広い性質を示す。しかしながら, この全ての多様性の中に見つけられるパターンが存在する。
III族からVII族までのp-ブロック元素全ての元素の電子構造は希ガスと一緒の充満した外殻と不完全な p 副殻の電子構造に対応している。例えば, ケイ素 (周期3, 6族) の電子構造は [Ne]3s23p2 である。加えて, 周期4と5のp-ブロックの元素は d 副殻をもつ, すなわち, ゲルマニウム Ge は [Ar]3d104s24p2 である。また周期6のp-ブロック元素は完全な f 副殻をもつ, すなわち, 鉛 Pb は [Xe]4f145d106s26p2 である。
注意する2つの点は最外殻の軌道は p 軌道であること, s と p の電子の全数は族の数に等しいことである。例えば, 上で挙げられた3つの元素の電子構造は全てが ns2np2 で終わっている。それ故これらの元素の各々は IV族の数 (いわゆる 2 + 2 = 4) である。硫黄 S の元素は [Ne]3s23p4 の電子構造を持ちそれ故 IV族の数である。
III族からVII族まで含む p ブロック元素は充填で不完全な p 軌道を持っている。
アルミニウムは周期表のIII族である (いわゆる長周期型のXIII族)。アルミニウムの電子構造は Al [Ne]3s23p1 でありそれ故各原子は分子中の3つの電子対だけに寄与できる。塩化アルミニウムのルイス構造図は式 AlCl3 の分子で1つのアルミニウム原子に3つの塩素原子が各々共有単結合している。しかしながら, 固体アルミニウムの実際の式は (実験によって決定されるように) Al2Cl6 である。この分子は2つのAlCl3 分子が一緒に結合したものである。以下の説明でどうしてこの配置が成し遂げられるのかを示す。各アルミニウム原子はもう一方のアルミニウム原子にくっ付いている1つの塩素原子によって与えられる孤立電子対を受け入れる。このような結合が配位結合で, それは電子対付与の傾向を示す。Al2Cl6分子は2つのAlCl3中のアルミニウムと塩素の原子間の各配位結合によって形成される。
ii の答
上図B (image607)
iii の答
固体が加熱されるとき, 固体中の粒子間の結合は弱い部分から切断され始めて, その固体は相変化で液体や気体になる。
ケイ素のような結晶固体と比較すると, 塩化アルミニウム固体は AlCl3 や Al2Cl6分子から成り立ちそれらの間で分散力の弱い結合を形成しているので, 比較的低い温度で気化する。
分散力は極性と無極性分子の両方の沸点を考察するときに重要となる。
液体が沸騰するとき, 液体状態の分子間引力の全てに打ち勝つためのエネルギーが要請される。
分散力は原子と分子間に作用する引力である。それらは弱く, 共有結合の5%の強度よりも小さい。分散力は原子や分子内の瞬間的で不均一な電子分布から生じる。平均すると, 無極性分子 (または個々の原子) 内の電子密度が均等に分布されている。しかしながら, 一瞬では, その分布は均一ではなく一時的な双極子が生じる。一時的な双極子がそのとき隣接分子内の電子を起因として力が引き合うように自分自身を配列させる。
この種の一時的な双極子はまた誘導双極子と呼ばれる。双極子は近辺の他の分子内の双極子を誘導しながら, 現れたり消えたりして揺れている。これらの双極子の全ては隣接分子内の電子密度の引き付けや反発により分子間の吸引力を維持するように調整する。
分散力は関連する分子の極性の増加で増大する。極性は外部電場にさらされるとき電子密度がどのような難易さで歪むかで測定する。それは多くの因子に依存する;例として極性は一般に分子の表面領域および存在する電子数にそって増加する。