[Answer]
Answer of a
Element : Copper Electronic configuration : 1s22s22p63s23p63d104s1 Blok : d
Element : Gallium Electronic configuration : 1s22s22p63s23p63d104p24s1 Blok : s
Element : Phosphorus Electronic configuration : 1s22s22p63s23p3 Blok : p
● The elements in s-block have a valence-shell electronic structure of either ns1 (Group I) or ns2 (Group II).
● The electronic structure of all p-block elements in Groups III to VII corresponds to the electronic structure of a noble gas together with a full outer shell and an incomplete p subshell.
● The transition metals occupy the central region of the periodic table in Periods 4, 5, and 6. A set of five d orbitals fills with a total of 10 electrons in the course of each period. You would expect the 3d subshell to fill with electrons smoothly from one to ten. However, there are two places where the filling does not follow this expected sequence.
a の答
元素 : 銅 電子構造 : 1s22s22p63s23p63d104s1 ブロック : d
元素 : ガリウム 電子構造 : 1s22s22p63s23p63d104p24s1 ブロック : s
元素 : リン 電子構造 : 1s22s22p63s23p3 ブロック : p
● s-ブロックの元素は ns1(I族) か又は ns2(II族) のいずれかの原子価-殻の電子構造を持つ。
● III族からVII族までの全てのp-ブロック元素の電子構造は希ガスと共に充満外殻と不完全 p 副殻の電子構造に対応している。
● 遷移金属は周期 4, 5, 6 の中の周期表の中央部分を占めている。5つのd軌道のセットは各周期のコースにおいて全体で 10電子で満たされる。3d副殻は 1個から 10個までスムーズに電子で満たされることが予期される。しかし, その充満はこの予期される配列には従わない2つの場所が存在する。
The elements in s-block have a valence-shell electronic structure of either ns1 (Group I) or ns2 (Group II).
s-ブロックの元素は ns1(I族) か又は ns2(II族) のいずれかの原子価-殻の電子構造を持つ。
The electronic structure of all p-block elements in Groups III to VII corresponds to the electronic structure of a noble gas together with a full outer shell and an incomplete p subshell. For example, the electronic structure of silicon Si (Period 3, Group IV) is [Ne]3s23p2.
III族からVII族までの全てのp-ブロック元素の電子構造は希ガスと共に充満外殻と不完全 p 副殻の電子構造に対応している。例として, ケイ素Si (周期3, IV族) の電子構造は [Ne]3s23p2 である。
The transition metals occupy the central region of the periodic table in Periods 4, 5, and 6. A set of five d orbitals fills with a total of 10 electrons in the course of each period.
You would expect the 3d subshell to fill with electrons smoothly from one to ten. However, there are two places where the filling does not follow this expected sequence. For example, chromium has the electronic structure 3d54s1 and not 3d44s2 ; and copper has the electronic structure 3d104s1 and not 3d94s2.
遷移金属は周期 4, 5, 6 の中の周期表の中央部分を占めている。5つのd軌道のセットは各周期のコースにおいて全体で 10電子で満たされる。
3d副殻は 1個から 10個までスムーズに電子で満たされることが予期される。しかし, その充満はこの予期される配列には従わない2つの場所が存在する。例えば, クロムは電子構造が 3d54s1 で 3d44s2 ではない ; そして銅は電子構造が 3d104s1 で 3d94s2 ではない。
The 2-BLOCK ELEMENTS OF S-BOLCK
The s-block elements consist of the metals contained in Groups I and II of periodic table. These two groups are referred to as the s block because the elements in them have a valence-shell electronic structure of either ns1 (Group I) or ns2 (Group II). Group I contains the elements lithium to francium, and Group II contains the elements beryllium to radium. Compared to most other metals, the s-block metals have generally greater chemical reactivity.
s-ブロックの2-ブロック元素
s-ブロック元素は周期表のI族とII族に含まれる金属から成る。これらの2つの族はそれにある元素がns1(I族)またはns2(II族)のいずれかの原子価−殻電子構造をもつのでsブロックとして引用される。I族はリチウムからフランシウムまでの元素を含み, そしてII族はベリリウムからラジウムの元素を含む。ほとんどの他の金属と比較して, s-ブロックの元素は一般により大きな化学的活性をもつ。
GROUP I AND GROUP II METALS : AN OVERVIEW
The Group I elements show the typical properties of metals : a freshly cut surface is shiny, electrical and thermal conductivities are high, and elements are ductile and malleable. The presence of just one electron in the valence shell leads to these elements forming compounds containing the M+ ion.
I族とII族の金属 : 共通見解
I族元素は金属の特性を示す : フレッシュな切断表面は光沢で, 電気と熱の伝導性が高く, 元素は延性と展性である。原子価殻中にちょうど 1個の電子の存在はこれらの元素にM+イオンを含む化合物を形成するように誘導する。
The Group II elements likewise show typical properties of metals, although beryllium shows some anomalies. There are two electrons in the valence shell, so the electrons magnesium to barium form compounds containing the M2+ ions.
For historical reasons, the Group I and Group II elements are sometimes known respectively as the alkali metals and the alkaline earth metals.
II族の元素はベリリウムは異常性を示すけれども, 同様に金属の典型的な性質を示す。原子価殻には2つの電子が存在し, そこでマグネシウムからバリウムまでのその電子はM2+イオンを含む化合物を形成する。
歴史上の理由で, I族とII族の元素は時によってそれぞれアルカリ金属とアルカリ土類金属として知られている。
Extraction OF S-BLOCK METALS
The s-block metals are extracted by electrolysis of a molten salts.
s-ブロック金属の抽出
s-ブロック金属は溶融塩の電気分解によって抽出される。
THE P BLOCK ELEMENTS
The p block includes all elements in Groups III to VII inclusive in the periodic table. For example, the p-block elements are aluminum, silicon, phosphorus, sulfur, and chlorine. They show an enormously wide range of properties, from highly reactive non-metals, to mildly reactive metals. However, there are patterns to be discovered among all this variety.
p ブロックの元素
p ブロックは周期表の中においてIII族からVII族までにある全ての元素を含んでいる。例えば, p-ブロック元素はアルミニウム, ケイ素, リン, 硫黄, および塩素である。それらは非常に活性な非金属から穏やかな性質の金属まで, 非常に幅広い性質を示す。しかしながら, この全ての多様性の中に見つけられるパターンが存在する。
Electronic structures
The electronic structure of all p-block elements in Groups III to VII corresponds to the electronic structure of a noble gas together with a full outer shell and an incomplete p subshell. For example, the electronic structure of silicon Si (Period 3, Group IV) is [Ne]3s23p2. In addition, the p-block elements of Periods 4 and 5 have d subshell, e.g. germanium Ge is [Ar]3d104s24p2. The p-block elements of period 6 also have a complete f subshell, e.g. lead Pb is [Xe]4f145d106s26p2.
III族からVII族までのp-ブロック元素全ての元素の電子構造は希ガスと一緒の充満した外殻と不完全な p 副殻の電子構造に対応している。例えば, ケイ素 (周期3, 6族) の電子構造は [Ne]3s23p2 である。加えて, 周期4と5のp-ブロックの元素は d 副殻をもつ, すなわち, ゲルマニウム Ge は [Ar]3d104s24p2 である。また周期6のp-ブロック元素は完全な f 副殻をもつ, すなわち, 鉛 Pb は [Xe]4f145d106s26p2 である。
Two points that you should note are that the outermost orbitals are p orbitals, and that the total number of s and p electrons is equal to the group number. For example, the electronic structures of the three elements given above all end with ns2np2. Each of these elements is therefore a member of Group IV (i.e. 2 + 2 = 4). The element surphur S has the electronic structure [Ne]3s23p4 and is therefore a member of Group VI.
注意する2つの点は最外殻の軌道は p 軌道であること, s と p の電子の全数は族の数に等しいことである。例えば, 上で挙げられた3つの元素の電子構造は全てが ns2np2 で終わっている。それ故これらの元素の各々は IV族の数 (いわゆる 2 + 2 = 4) である。硫黄 S の元素は [Ne]3s23p4 の電子構造を持ちそれ故 IV族の数である。
SUMMARY
● The p-block elements in Groups III to VII inclusive have incompletely filled p orbitals.
● The elements of Group IV show the greatest change in character, from non-metallic (carbon) to metallic (lead).
まとめ
● III族からVII族までの中にある p-ブロック元素は p軌道が満たされていない。
● IV族の元素は, 非金属 (炭素) から金属 (鉛)で, 性質に最も大きな変化を示す。
The first row of the d block : scandium to zinc
The transition metals occupy the central region of the periodic table in Periods 4, 5, and 6. A set of five d orbitals fills with a total of 10 electrons in the course of each period. Here, the metals will concentrate on the chemistry of elements selected from the first row of the d block, the Period 4 elements scandium Sc to zinc Zn.
d ブロックの最初の列 : スカンジウムから亜鉛まで
遷移金属は周期 4, 5, 及び 6 の中において周期表中央部を占めている。5つのd軌道セットは各周期のコースにおいて全体で 10 の電子で充満する。ここでは, その金属はd ブロックの最初の列から選択された元素, 周期4の元素スカンジウムScから亜鉛Znまでの化学についてのみ考慮される。
Calcium is the metal immediately before scandium in Period 4. All the elements of the first row of the d block have greater first ionization energies than calcium.
カルシウムは周期4においてスカンジウムの直前の金属である。d ブロックの最初の列の全元素はカルシウムよりもより大きい第1イオン化エネルギーを持つ。
Notice that both the atomic radius and the ionization energy have similar values from titanium Ti to copper Cu. Atomic size decreases overall across Periods 2 and 3 because the increasing nuclear charge attracts the electrons in the outer orbitals more strongly.
原子半径とイオン化エネルギーの両方ともチタニウムTi から銅Cuまで似た値を持つ。原子の大きさは全体的に周期 2と3にそって減少するがその理由はその増加する核電荷が外殻軌道の中に電子をより強く引き付けるからである。
Throughout this first row of the d block, however, the atomic size changes very little. The electrons are being added to inner d orbitals, where they are much more effective at shielding the outer s electrons from the increasing nuclear charge. As a result, the ionization energy also increases very little across the period because the outer 4s electrons are well shielded from the nuclear charge.
しかし, d ブロックのこの最初の列を通して, 原子の大きさはわずかに変化するだけである。電子は内部のd軌道へ加えられるようになり, そこでは, その電子は外殻 s 電子を増加する核の電荷から遮蔽することでより効果的に作用する。結果として, イオン化エネルギーもまた周期にそって僅かしか変化しないがその理由は外殻4s電子が核の電荷からよく遮蔽されているからである。
● The atomic radius decreases quite sharply from calcium to chromium, after which there is little change in the value.
● The first ionization energy shows a rather gentle general increase across the d bock, with a sharp increase from copper to zinc.
● 原子半径はカルシウムからクロムまで完全にシャープにへっていき, その後でその値において変化が少なくなる。
● 第1イオン化エネルギーはその d ブロックにそってむしろ穏やかな普通の増加を示し, 銅から亜鉛でシャープな増加になる。
Electronic structures
The 3d orbitals are filling as atomic number increases from Ti to Cu. Look at the sequence of electronic structures opposite. You would expect the 3d subshell to fill with electrons smoothly from one to ten.
電子構造
3d 軌道は原子番号が Ti から Cu まで増加するにつれ満たされていく。逆の電子構造の配列に注意することが必要である。3d の副殻は電子を 1つから 10 までスムーズに充満することを予期すると考えられる。
However, there are two places where the filling does not follow this expected sequence. Chromium has the electronic structure 3d54s1 and not 3d44s2 ; and copper has the electronic structure 3d104s1 and not 3d94s2
しかし, その充満は予期される配列に従わない2つの場所が存在する。クロムは電子構造 3d54s1 を持ち 3d44s2 ではない ; 銅は電子構造 3d104s1 をもち 3d94s2 ではない。
. This is because the 3d and 4s orbitals are very close in energy ; as electrons are added across the period, their relative energies change. At chromium, it is energetically favorable for all the orbitals to be half-full ; in agreement with Hund's rule, the five electrons have unpaired spins.
At copper, it is energetically favorable to fill the d orbitals completely, leaving the 4s orbitals with an unpaired electron, as the 3d orbitals are now lower in energy than the 4s orbitals.
このことは 3d と 4s の軌道はエネルギーにおいて非常に密接であるという理由による ; 電子が周期にそって加えられるつれ, それらの相対的なエネルギーは変化する。クロムでは, 全ての軌道に対して半充満であることがエネルギー的に好都合であり ; これはフントの規則に一致し, その5つの電子は不対スピンを保持する。
銅では, 不対電子での4s軌道を残したままで, d軌道を完全に満たすことがエネルギー的に適合しており, それは 3d 軌道が目下のところ 4s軌道よりもエネルギーにおいて低いからである。
Answer of b
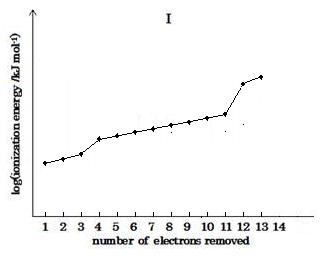 (image605)
(image605)The graph shows steady increase with steep rises between 3th and 4th, and 11th and 12th of electrons.
These observations suggest that the increases in the ionization energy occur when electrons being removed come from a new shell (L of 4th or K of 12th), closer to the attractive charge of the nucleus.
b の答
 (image605)
(image605)グラフは段階的な増加を示すと共に3番目と4番目, および11番目と12番目の電子間に急な上昇がある。
この現象は次のように説明される即ちそのイオン化エネルギーの増加は除去される電子が核の吸引電荷に近い新殻 (4番目のL殻または12番目のK殻) から引き抜かれるときに生じる。
The electronic structure of Al is
Al : 1s22s22p63s23p1
The energy levels of the orbitals are shown in order as follows ;
1s<2s<2p<3s<3p
An ionization energy is the minimum energy required to remove electrons from an isolated atom in the gas phase, represented for Al as follows :
Al → Aln+ + ne-
Al の電子構造は
Al : 1s22s22p63s23p1
である。軌道のそのイオン化エネルギーは順序において次のように示される ;
1s<2s<2p<3s<3p
イオン化エネルギーは気相の孤立原子から電子を除くに要する最小のエネルギーである。Al では次のように表わされる :
Al → Aln+ + ne-
So, when a large energy is given in an isolated Al atom, first, one electron of the 3p1 orbital is more easily removed because of being in the furthest subshell from the nucleus than other electrons (i.e. the ionization energy of the 3p1 orbital has the less value). Moreover, adding the energy in succession to Al for ionization, the each electron in Al becomes free respectively steadily from the outer shell with increasing in ionization energy.
そこで, 大きなエネルギーが孤立したAl原子に与えられると, 最初に, その 3p1 軌道の 1つの電子はより容易いに除かれるがその理由は他の電子よりも核から最も離れた副殻にあるからである (即ち, その 3p1 軌道のイオン化エネルギーが最も小さい値を持つ)。さらに, イオン化に対して Al にエネルギーを継続して加えると, Al中の各電子はイオン化エネルギーの増加で外殻からそれぞれ段階的にフリーになる。
Not that there is a significant increase in energy needed between removing the third and fourth electrons, and that another significant large increase between the eleventh and twelfth electrons. These observations suggest that the increases in ionization energy occur when electrons being removed have to come from a new shell, closer to the attractive charge of the nucleus.
The graph shows steady increase with steep rises between 3th and 4th, and 11th and 12th of electrons.
3番目と4番目の電子を除去する間に必要とするエネルギーの顕著な増加が存在し, そしてもう1つの顕著な増加が 11番目と 12番目の電子の間にある。これらの現象は次のことが想定される, 即ちイオン化エネルギーの増加は除去される電子が核の吸引電荷により接近した, 新たな殻から引き抜かれねばならないときに生じる。
そのグラフは段階的な増加を示すと共に3番目と4番目, および11番目と12番目の電子間に急な上昇がある。
EFFECTS OF ATOMIC SIZE
The size of an atom has an influence on its ionization energy, which is the minimum energy required to remove one or more of the outermost electrons. In turn, the ionization energy influences the valency of an element expressed as the oxidation number. The values of these three interlinked attributes - atomic radius, ionization energy, and oxidation number - all show clear trends as the atomic numbers of the electrons increase across a period.
原子の大きさの影響
原子の大きさはそのイオンエネルギー化エネルギーに影響を及ぼし, そのエネルギーとは1個またはそれ以上の最外殻電子を除くのに必要とする最小限度のエネルギーである。同時に, そのイオン化エネルギーは酸化数として表わされる元素の原子価に影響する。これらの3つの連結された値−原子の大きさ, イオン化エネルギー, そして酸化数−の全ては原子番号での電子が周期にそって増加するときにはっきりとした傾向を示す。
Trends in atomic radius
In each period of the periodic table, the Group I metal has one valence electron outside filled inner shells which partially shield that electron from the nuclear charge. In Periods 2 and 3, the atomic radius decreases steadily as atomic number increases from Group I from Group VII. The steady increase in nuclear charge pulls all electrons closer to the nucleus. In Period 4, the trend seen in the previous two periods is less smooth because of the d-block elements, in which the inner 3d subshell is filling.
Figure
(Atomic number - Atomic radius/nm)
Plots of atomic radius against atomic number for Period 2, 3, and 4.
原子半径の大きさ
周期表の各周期において, I族の金属は外側に1個の原子価電子を持ち充満した内部殻は核電荷からその電子を部分的に遮蔽している。周期2と3においては, 原子半径は原子番号がI族からVII族まで増加するにつれ段階的に減少する。核電荷のその段階的増加は全ての電子を核の方へより接近するように引っ張る。周期4では, 先の2つの周期に見られた傾向は内部の3d副殻が充満しているd-ブロック元素のために少しなめらかでなくなる。
図
(原子数 - 原子半径/nm)
周期 2, 3, および4 での原子番号に対する原子半径のプロット
Shielding
Each successive element across a period contains one more proton and electron. The extra electron might be expected to shield (cancel out the attraction of) the extra proton. This shielding is only partially successful ; electron density is smeared out, whereas the protons are definitely located in the nucleus.
This lack of perfect shielding means that the effective nuclear charge experienced by an electron increases across a period ; the increasing nuclear charge outweighs the effect of an extra electron in the same shell.
遮蔽
周期にそっての継続する元素の各々は 1個以上の陽子と電子を含む。余分の電子はその余分の陽子を遮蔽することが (その陽子の引力を相殺することが) 予期される。この遮蔽は部分的にのみ影響し ; 電子密度はぼやけており, 一方陽子は核の中に明確に極在化されている。
この不完全な遮蔽は次のことを意味する, すなわち1個の電子によって試される実質的核電荷は周期にそって増加し ; その核電荷の増加は同じ殻内の過剰電子の効果よりも勝る。
First ionization energy
Atomic size decreases across a period as atomic number increases. It is therefore reasonable to expect the first ionization energy to increase as the valence electron becomes closer to the nucleus. While this is generally true, there are two other points of interest to note 'dips' at Groups III and VI.
Figure
(Atomic number - First ionization energy/kJ mol-1)
Plots of this ionization energy against atomic number for Z = 11(Na) to Z = 18 (Ar). The plot shows that is there is a periodic variation in ionization energy across Period 3.
The first ionization energy is the minimum energy required to remove one electron from an isolated atom in the gas phase, represented for a general element E as :
E(g) → E+(g) + e-(g)
(Values are usually quoted per mole.)
第1イオン化エネルギー
原子の大きさは周期にそって原子番号が増加するにつれ減少する。それゆえ原子価電子が核により近ずくにつれ第1イオン化エネルギーを増加させることが予期されることは当然である。このことは本当である一方, 族IIIとVIでの下降に注目すべき他の2つの関心点が存在する。
図
(原子番号 - 第1イオン化エネウギ−/kJ mol-1)
Z = 11 (Na) から Z = 18 (Ar) までの原子番号に対するこのイオン化エネルギーのプロット。プロットは周期3にそってのイオン化エネルギーの周期的変化が存在することを示す。
第1イオン化エネルギーは :
E(g) → E+(g) + e-(g)
のように一般の元素 E に対して表わされ, ガス状の孤立原子から 1個の電子を除くのに要請される最小限のエネルギーである。
The Group III / Group VI 'dips'
In Periods 2 and 3, there is a small dip in the plot at the Group III elements and at the Group VI elements. The dip at beryllium / boron (in Period 2) provides evidence for electron subshells. In Period 3, the first ionization energies of aluminium and sulfur are lower than expected. In the case of the Ma / Al, the electron that is removed in Al is from the 3p subshell, which is further from the nucleus than the 3s electron that is removed from Ma. It therefore requires less energy to remove the electron during ionization. In the case of elements P / S, the 3d electrons in phosphorus all occupy separate orbitals. The fourth p electron in sulfur must enter one of these orbitals, resulting in increased electron repulsion and a lower ionization energy than otherwise expected.
III族/VI族の下降
周期2と3において, III族元素/VI族元素でプロットの小さな下降が存在する。ベリリウム/ホウ素 (周期2) でのその下降は電子副殻によるものである確証を用意する。周期3では, アルミニウムと硫黄の第1イオン化エネルギーが予期されるよりも低い。Ma/Al の場合, Al 中の除去される電子は3p副殻からであり, それはMg から除去される3s電子よりも核からより離れている。それゆえイオン化で電子を除去するのに少ないエネルギーで済む。元素P/Sの場合では, リンの中の3d電子全ては隔離の軌道を占めている。硫黄中の4番目のp電子は
Answer of c
Element : Sodium
Name of the crystal structure : Body-centered cubic structure
Coordination number : 8
Element : Magnesium
Name of the crystal structure : Hexagonal closed-packed structure
Coordination number : 12
c の答
元素 : ナトリウム
結晶の名称 : 体心立方格子
配位数 : 8
元素 : マグネシウム
結晶の名称 : 六方最密構造
配位数 : 12
Simple cubic structure
Simple cubic structure results when square layers are placed exactly one top of another. The layers repeat
in the sequence AAA …. This means that the ions (spheres) in layers 2, 3, …are in exactly the same positions as those in layer 1. This arrangement represents the the least-efficient occupancy of space possible.
The coordination numbers of an ion gives the number of its nearest neighbors. The coordination number for simple cubic crystal structure is 6 because each ion has six nearest neighbors. The only metal with the simple cubic structure is polonium.
単純立体格子
単純立方格子は正方形の層が他の頂点に正確に置かれているときに生じる。その層は配置AAA…でくり返される。これは次のことを意味する, すなわち二層, 三層にある球状のイオンが正確に一層の同じ位置に存在する。この配列は最小の空間占有率を可能にすることを表わしている。
ある1つのイオンの配位数はその最も近い隣接イオン数を与える。単純立体結晶格子の配位数は各イオンが6つの最も近い隣接イオンを保持しているので6である。単純立体格子の唯一の金属はポロ二ウムである。
Body-centered cubic structure
The ions in each square layer can be arranged to fit into the hollows between the ions in the layer immediately below. The square layers are then in the alternating sequence ABAB…. (This means that the ions in 1, 3, 5, …are in exactly the same relative positions, but different from those in layers 2, 4, 6,….) This is a more efficient use of space (68% of space is filled compared with only 52% for simple cubic). The coordination number is 8 and the unit cell is described as body-centered cubic (b.c.c.).
Group I metals adopt the body-centered cubic structure, and their low densities reflect the relative openness of the b.c.c. structure, compared with the close packing other.
体心立方格子
各正方層の中のイオンはすぐ下の層の中のイオン間の穴へ適合するように配列するようにすることができる。そのとき正方層は二者択一的な配列 ABAB…で存在する。(これは 1, 3, 5 の中のイオンが正確に同じ相対位置に存在するが, 2, 4, 6 の層のものとは異なっていることを意味する。) これは空間のより効率的占有である (単純立方での 52%だけと比較して空間の68%が満たされている)。配位数は8で単位格子は体心立方 (b.c.c.) として記述される。 I族の金属は体心立方格子に採り入れられ, そしてそれらの小さい密度は, 他の密な充填と比較して, b.c.c.格子の相対でのすき間形成に影響を及ぼしている。
Hexagonal close-packed structure
Hexagonal layers can stack one on another in the alternating sequence ABAB…. (Note that the labels A and B now refer to hexagonal layers.) The coordination number is 12, representing the most efficient use of space possible (74% of space is filled). The unit cell is called the hexagonal close-packed (h.c.p) structure.
Magnesium, zinc, and titanium are among the common metals to adopt the hexagonal close-packed structure in the solid state.
六方最密充填構造
六方の層は二者択一での順序 ABAB…において相互に積み重なっている。(層AとBはいま六方の層で参照していることに注意。) 配位数は12であり, 可能な空間の最効率占有を表わしており (空間の74%が充満している)。単位格子は六方最密充填 (h.c.p.) 構造と呼ばれている。
マグネシウム, 亜鉛, そしてチタンが固体状態で六方最密充填構造に取り上げられる一般的金属の範疇にある。
The hexagonal close-packed structure - showing the hexagonal layers staked ABAB…. The layers have been colored differently so that it is easier to see the arrangement, but all the spheres are identical.
Figure
(The ions in layer 2 lie in hollows between the ions in layer 1. The ions in layer 3 lie directly above the ions in layer 1. Space filling model of unit cell. Ball and stick model of unit cell.)
六方最密充填構造 - ABABで積み上げられた六方の層を示す。その層は異なった色で分けられておりその結果配列を見分けるのが容易である, ただし全ての球は同一である。
図
(層2の中のイオンは層1の中のイオン間の穴に存在する。層3の中のイオンは層1の中のイオン上に直接存在している。 単位格子の空間充填模型。 単位格子のボールと棒による模型。)
Cubic close-packed structure
There is another way in which hexagonal layers can stack together. Instead of layer 3 being the same as layer 1, it can fit over the hollows in both the first two layers. This structure results in the sequence ABCABC…. The occupancy of space is the same as in the hexagonal close-packed structure (74%) and the coordination number is also 12. This unit cell is called the cubic close-packed structure, but may also be described as face-centered cubic (f.c.c.). The easiest way to understand the alternative name is to view at an angle from the close-packed planes. There is a sphere at each corner of the cube and also spheres at the center of each of the faces. Aluminum, copper, silver, and gold are among the common metals to adopt the cubic close-packed structure in the solid state.
立体最密格子
六方層が共に積み重なることができるもう一つの仕方がある。層1と同じ状態である層3に代わって, それは最初の2層の両方の穴上に合うようにすることができる。この構造は結果として配列が ABCABC…のようになる。空間の占有率は六方最密構造 (74%) と同じで配位数はまた 12 である。この単位格子は立方最密構造と呼ばれるが, また面心立方 (f.c.c.) として記述される。この二者択一での名称を理解する最もよい方法は最密で充填されている面から眺めてみることである。立方の各々の角に球が存在しそしてまた各面の中心に球が存在する。アルミニウム, 銅, 銀, および金が固体状態で立方最密構造に適合するありふれた金属の範疇にある。
The cubic close-packed structure - showing the hexagonal layers stacked ABCABC…. Again, the layers have been colored differently so that it is easier to see the arrangement, but all spheres are identical.
Figure
(The ions in layer 2 lie in the hollows between the ions in layer 1. The ions in layer 3 lie above the hollows in layers 1 and 2. The space filling model of unit cell. Ball and stick model of unit cell.)
立方最密構造 - ABCABC…で積み上げられた六方の層を示している。再びその層が異なった色で表わされておりその結果として配列を見るのが容易であるが, ただし全ての球は同一である。
図
(層2のイオンは層1のイオン間の穴に位置する。層3のイオンは層1と2の穴上に位置している。 単位格子の空間充填模型。 単位格子のボールと棒による模型。)
Summary
● Square layers stack AAA…to give the simple cubic structure or ABAB…to give the body-centered structure.
● Hexagonal layers stack ABAB…to give hexagonal close-packed structure or ABCABC…to give the cubic closed-packed structure.
● Cubic close packing may also be called face-centered cubic.
まとめ
● 正方層は AAA…の積み上げで単純立方構造を形成する又は ABCABC…で立方最密構造を形成する。
● 六方層は ABAB…の積み上げで六方最密構造か又は ABCABC…で立方最密構造を形成する。
● 立方最密充填はまた面心立方と呼ばれる。